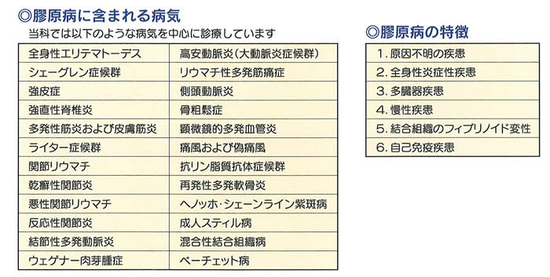
膠原病
膠原病とは、病理学者クレンペラーによって1942年に提唱された疾患群です。それまでは「病気とは特定の臓器に存在するものである」と考えられていましたが、多数の臓器が同時に障害される病気もあるとを見つけて「膠原病」と命名しました。「膠原」とは膠原線維という結合組織の成分に由来しており、「結合組織病」とも言われたり、「リウマチ性疾患」「自己免疫性疾患」という呼ばれたりします。聞き慣れない疾患ばかりと感じますが、実は、シェーグレン症候群などは、決して珍しくないんです。これらの疾患をどう理解するかなかなかの難題です。
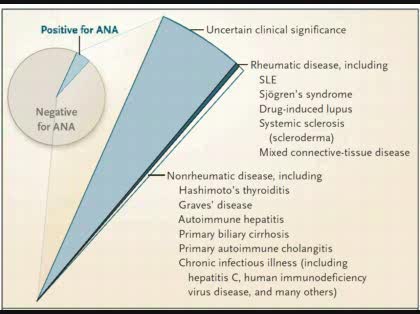
何らかの機会に血液検査を受けたとき抗核抗体が陽性であることが偶然見つかって、「膠原病の疑いがある」と言われたという人がたくさんおられますが、ほとんどの場合は膠原病ではありません。なんの自覚症状もないのに抗核抗体だけが陽性の人はたいてい健康人です。抗核抗体をランダムに100人に測るとだいたい5%ぐらいが陽性になります。そのほとんどは、健康人なんです。臨床的に意義のあるものとして一部に膠原病があるのですが、甲状腺疾患(橋本病、バセドウ病など)慢性肝炎などでも陽性になります。
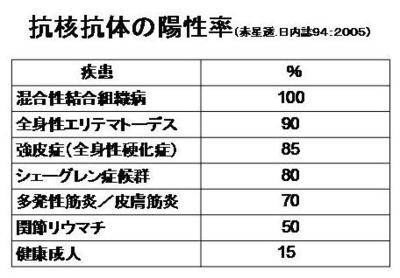
一方で、膠原病であることの特徴のひとつに抗核抗体が陽性になると言うのも事実です。だから抗核抗体が陽性になる膠原病と抗核抗体が関係しない膠原病に分類するのもいいかもしれません。混合性結合組織疾患は、抗核抗体陽性が診断基準になっているので、100%ですが、SLEや全身性硬化症も抗核抗体が陰性だとちょっと考えにくいかも知れません。反対に、関節リウマチやベーチェット病、成人スティル病、血管炎、血清反応陰性脊椎炎、リウマチ性多発筋痛症などは、抗核抗体が診断とは関係ない膠原病です。
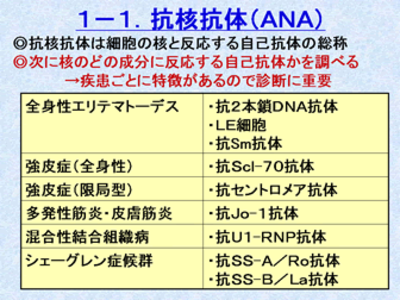
抗核抗体は、不明熱や関節炎の患者さんが来て、膠原病かなと思って検査に出してしまって、結果が陽性で帰ってきたとしても、膠原病である確率よりも健常者でたまたま陽性に出る確率の方がよっぽど高いので、なにを調べたのかわからなくなってしまいます。つまり、抗核抗体は、膠原病のスクリーニング検査にではなくて、SLEや全身性硬化症など抗核抗体関連関連膠原病を疑う患者さんに対して行う検査であり、抗核抗体関連膠原病には、それぞれの膠原病における特異抗体があり、診断をつけるときに役に立ちます。しかし、実際の臨床の現場では、全身性硬化症では、皮膚硬化を認めますし、シェーグレン症候群だと乾燥症状(目や口が渇く)があります。皮膚筋炎/多発性筋炎だとゴットロン、ヘリオトロープ、筋肉痛、筋力低下などを認めますし、混合性結合組織疾患では、ソーセージ指などの特徴的な臨床所見から、おおよそ見当がつきます。しかし、SLEは、症状が多彩で、これといって特徴的な臨床所見がありません。(蝶形紅斑は、経過を通じて半分しか認めません)よって、抗核抗体は、SLEを疑った時に行う検査と言うことになります。

膠原病の疾患群で最も多いのは、関節リウマチです。関節リウマチは、70万人もいる一大疾病なので、別枠でページを割いてお話しするとして、膠原病の多くは、厚生労働省が特定疾患治療研究対象疾患 (いわゆる難病)に指定し、公費補助される疾患です。(概ね10万人以下で原因不明)
目 ぶどう膜炎(虹彩より深い部位)がないか
口 口内炎(ベーチェット、SLE)唾液のプール、虫歯(シェーグレン)
肺 間質性肺炎 肺高血圧症(IIp)息切れ
指・爪 レイノー現象 リベドー 乾癬、毛細血管の異常(PM/DM、強皮症、SLE)
全身性エリテマトーデス(SLE)
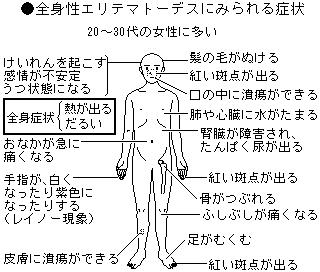
全身性エリテマトーデス(systemic lupus erythematosus)ちょっと難しそうな病名です。全身のという意味は、そのまま全身のさまざまな場所に、多彩な症状を引き起こすということを指しています。また、lupus(ラテン語で狼の意味)erythematosusとは、皮膚に出来る発疹が、狼に噛まれた痕のような赤い紅斑であることから、こう名付けられました。2~4万人程の患者さんがいると考えられています。男女比は1:9ほどで、圧倒的に女性に多い病気です。すべての年齢に発症しますが、15才から65才までの、子供を産むことの出来る年齢に多く起こります。その原因はわかっていませんが、疾患が起こるきっかけになるもの(誘因)がいくつか知られています。紫外線(海水浴、日光浴、スキーなど)風邪などのウイルス感染、怪我、外科手術、妊娠・出産などが知られています。遺伝については、この病気を持っているお母さんから、どの位の頻度でこの病気の子供が生まれるかは、一般のひとの発症頻度よりも高いと考えられていますが、一卵性双生児でも、30%程度ですから、残りの70%は何らかの環境要因が考えられます。
自分自身の体に対する免疫は、血液中の抗体を調べることによって判断できます。この病気の患者さんの95%以上が、血液中に抗核抗体という抗体をもっています。自分自身の細胞のなかにある核と反応してしまう抗体です。この抗体が、自分の細胞の核と反応し、免疫複合体という物質 を作って、全身の皮膚、関節、血管、腎臓などにたまって病気が引き起こされると考えられています。このほか、免疫を司るリンパ球も直接、自分の細胞、組織 を攻撃すると考えられています。
不明熱や関節炎などのいろいろな多彩な症状があって、なにかよくわからなくなった時に、いきなり、抗核抗体の検査をしても、さらに蟻地獄に陥るだけです。SLEがうまく頭に浮かんだ時には、診断基準の当てはめながら診察すればいいわけです。
診断基準(分類基準)を見てみましょう。
(感度96% 特異度96%)
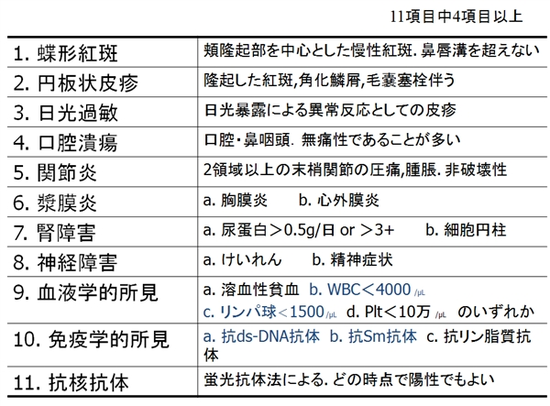
(1)から(9)までは、問診や診察、簡単な血液検査でわかります。4つ以上を満たすことが条件ですから、これらの最低でも2つ以上あったら、抗核抗体の検査を行いましょう。(1つしかない場合は、経過観察になります)
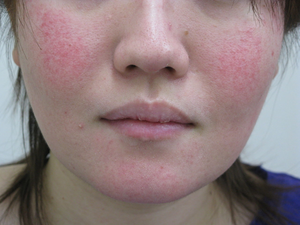
(1)蝶形紅斑
典型的には、鼻背から両頬にかけて、鼻の根元で紅斑がつながる左右対称の紅斑ですが、自覚症状はありません。初期には、比較的小さな範囲にしかできず、対称的でもありません。皮膚をさわると、一つ一つが丸い発疹が、重なりあい、少し盛り上がっている皮疹と盛り上がりのないハケで薄紅色の絵 の具をぬったような紅斑も見られます。
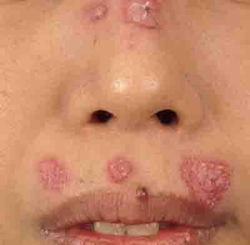
(2)円板状皮疹(ディスコイド疹)
表面にかさかさする鱗屑を伴うやや盛り上がったディスク状(レコード盤のような)円板状の紅斑で、顔面、耳、首のまわり、指関節背側などに好発します。
(3)日光過敏
強い紫外線にあたった後に、皮膚に赤い発疹、水膨れ、あるいは熱が出る人がいます。このような症状は、日光過敏症といいます。この症状が、病気の始まりであることも少なくありません。
(4)口腔潰瘍
多くは、口の奥、頬にあたる部位や上顎側に出来る粘膜面がへこんだもので、痛みが無く自分で気付かないことがしばしばです。痛みを伴うベーチェット病の口内炎と対照的です。
(5)関節炎
手や指が腫れて、痛む関節炎を起こしますが、関節リウマチのようなこわばりはあまりありません。肘、膝などの大きな関節に、日によって場所が変わる移動性の関節炎が見られることもあります。
(6)漿膜炎 その既往の確認、胸部Xpや心エコー検査で、胸水や心嚢液をチェックします。
(7)蛋白尿は、試験紙法ではなくて、蛋白/クレアチニン比で確認を
(8)中枢神経障害の痙攣は、SLEと診断される5年ほど前から認められていることが多く、既往歴の確認が大切です。
(9)WBCの数が4000以上あって、正常範囲でもリンパ球数が減っていることもよく見られます。白血球分画で、リンパ球数の絶対値を計算することが大切です。
その他の症状としては、初発症状がレイノー症状であったり、微熱が続いたり、頚部リンパ節腫脹(生検良性)、眼底(cotton-woolspot)が出現したりします。血液検査では、診断基準の他では、血沈が亢進しているわりに、CRPは正常から軽度上昇(シェーグレンと多発性骨髄腫も)に止まるのが特徴です。
手掌 手の先が紅くなる
Jaccoud関節 軟部組織が緩んで尺側偏位が起こる(リウマチ熱でもあるが、現在、リウマチ熱はほとんどいない)
その他の症状としては、脱毛があります。朝起きたときに、枕にこれまでなかったほどたくさん髪の毛がつくようになります。また、円形脱毛や髪が痛みやすく、髪の毛が途中から折れてしまったり、髪全体の量が減ったりすることもあります。
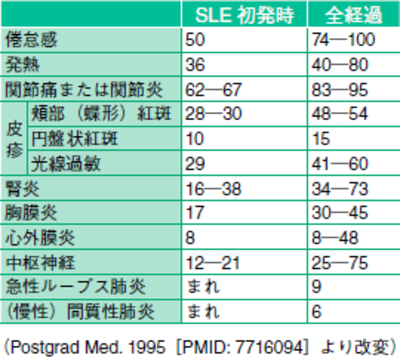
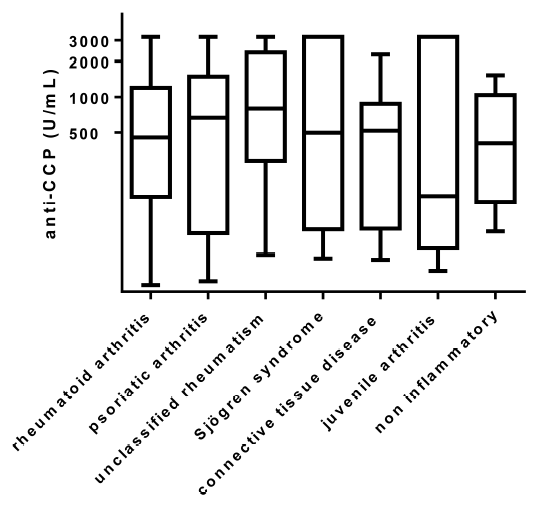
しかし、SLEの診断基準(米国リウマチ学会,1997)の中で、全身倦怠感や発熱、関節炎などの症状は、全経過を通してはかなりの確率で認められていますが、症状が揃うのにある程度時間を要します。実際の臨床現場で、発症早期の患者においては,初発症状だけでは、なかなか診断がむずかしいこともよくあるわけです。また、抗核抗体検査は感度は99%と高く、陰性であれば、SLEの除外診断に使えるわけですが、尤度比(診断に寄与する強さ)は低いわけです。(陽性であってもSLEだとは言えない)反対に、蝶形紅斑(57%)や血小板減少(21%)、光線過敏症(43%)などは感度はそう高くはありませんが、尤度比が高いので、あればSLEを強く疑うことがでるわけです。
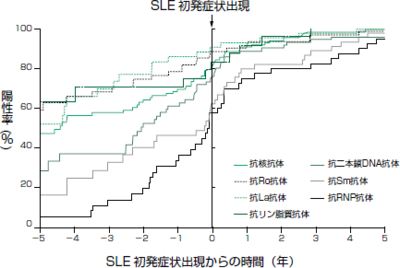
特異抗体もSLEの診断の早期では、陽性になっていないこともあるので注意が必要です。抗二本鎖DNA抗体と抗Sm抗体は,SLEにおける感度はそれぞれ70%,30%ですが,特異度はいずれも95%以上と高く,診断の補助になります。

Ⅲ型アレルギー
全身性エリテマトーデスの病態の機序は、Ⅲ型アレルギー(免疫複合体型またはArthus型)とも呼ばれ、薬物アレルギーや血清病、関節リウマチなどと同じで、免疫複合体(抗原と抗体がくっついたもの)組織に沈着して障害を起こします。正常な場合は、抗原と抗体(IgG抗体またはIgM抗体)が結合した抗原抗体複合体に補体が反応し、赤血球にくっついて肝臓や脾臓で処理されるわけですが、SLEの場合は、自己抗体が止めどなくできるので、処理しきれずに組織(腎、関節、肺、心臓、皮膚など)に沈着し、そこへ補体が反応し遊走因子(アナフィラトキシン)を出して、マクロファージ、好中球が集まって炎症を起こしたり、補体自身が細胞に孔を開けて壊したりします。
治療は、副腎皮質ステロイド剤が特効薬として知られています。代表的なもの はプレドニゾロンです。病気の重症度(臓器障害の広がり)によって、その薬の量を変わります。関節炎や皮膚症状だけなど、軽症なら15mg/日程度、一方、腎臓、中枢神経、血管炎などに広がり、重症なら60mg/日程度や多種類の薬剤を長期にわたって使わなければならないこともあります。また、最重症ならステロイドパルス療法が行われます。最初2週間から1ヵ月この量を続け、徐々に減らして10mg前後を長期に飲み続けます。(1日5mg相当のホルモンが体内から出ていますので、5mgのプレドニゾロンを飲むということは、自分自身が毎日作っている量と同 じ量を補うことになります)
副腎皮質ステロイド剤が、効果不十分か副作用が強い場合に、免疫抑制剤を使うことがあります。イムラン、エンドキサンなどです。
ステロイドや免疫抑制剤がどうしても使用できない、あるいは効果が不十分な場合には、体外循環療法が行われます。血液中の病気を引き起こしている免疫複合体やリンパ球を、体の外に取り出してこれをフィルターを使って取り除く治療法です。
予後予測に役立つ所見としては、ディスコイド診がある患者さんは、予後良好、腎炎(Cr>1.3)中枢神症状(痙攣 精神病)漿膜炎、血小板減少のある患者さんは、予後不良と言われています。フォローでは、新しい皮診を確認したり、CBCや腎機能、検尿、C4などを測定します。また、ステロイドを服用している患者さんが多いので、その合併症や動脈硬化についての検査を大切です。気をつけるお薬としては、イブプロフェンは、添付文書で、無菌性髄膜炎を増やすため、慎重投与になっています。妊娠希望者は、ステロイド以外は使えない(日本では)ので、専門医に任せましょう。

抗リン脂質抗体症候群
抗リン脂質抗体症候群(APS)は、血液中に抗リン脂質抗体(抗カルジオリピン抗体やループスアンチコアグラント)という自己抗体が証明され、習慣性に(2回以上)流産を起こしたり、動脈や静脈の中で血の固まりが出来る血栓症(脳梗塞、肺梗塞、四肢の静脈血栓症など)を起こしたり、血液検査上で血小板が減少するというような症状や所見をきたす疾患です。SLEの約10%がAPSを合併していると推定されること、原発性APSと合わせると約1万人の患者さんがいると推定されています。下肢の深部静脈の血栓症の頻度が最も高く、症状としては再発しやすい下肢の腫脹と疼痛が特徴です。また、肺に血栓が飛んで、肺動静脈血栓症や肺高血圧の原因となり呼吸不全を起こし命にかかわることもあります。脳の血管に血栓ができ、脳梗塞 や一過性脳虚血発作をきたすことも比較的多くみられます。一般的な治療法として、まず日常生活における血栓症の危険因子の除去が重要で、禁煙、高血圧や高脂血症の改善、経口避妊薬の中止が必要です。抗リン脂質抗体が陽性の場合でも、血栓症の既往や症状がない場合には積極的な治療の必要性はなく、通常経過観察のみでよいとされています。高齢者や血栓症のリスクが高いと思われる患者には、少量アスピリンやワーファリン(INR2~3)などを予防的に投与することもあります。血小板減少があり出血症状が認められるような患者に対しては、副腎皮質ステロイド薬や免疫抑制剤が使用されます。最近の研究でわかってきたことですが、実はこの抗体は、β2グリコプロテインⅠに対する抗体であり、β2グリコプロテインはリン脂質ではありません。検査も病名も間違っているわけで、今後訂正されるかもしれません。
シェーグレン症候群

シェーグレン症候群(1933年スウェーデンの眼科医)は、主として中年女性に好発する涙腺と唾液腺を標的とする(一部、全身性の臓器病変に)臓器特異的自己免疫疾患です。我が国の患者数は2万人(潜在的には10~30万人)と膠原病の中では比較的多く、主訴はドライマウスとドライアイで、とにかく乾いているという疾患です。原発性のシェーグレン病と膠原病(関節リウマチ、全身性エリテマトーデス、強皮症、皮膚筋炎、混合性結合組織病) に合併する二次性シェーグレン症候群に分類されます。
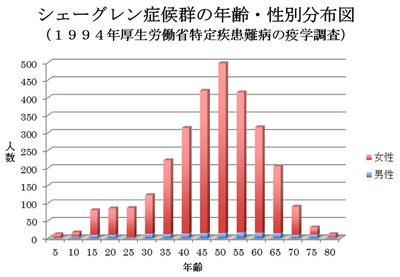
この疾患の発症の年齢層は50歳代にピークがあります。少数ではありますが、子供から80歳の老人(加齢でも唾液量が約半分に減る)まで発症することもあります。男女比は、1:14の圧倒的に女性に多い疾患です。

初発症状は、目の乾燥(ドライアイ、涙が出ない、目がころころする、目がかゆい 、目が痛い、目が疲れる、物がよくみえない、まぶしい、目やにがたまる、悲しい時でも涙が出ないなど)を訴え、口の乾燥(口が渇く、唾液が出ない、摂食時によく水を飲む、口が渇いて日常会話が続けられない、味がよくわからない、口内が痛む、外出時水筒を持ち歩く、夜間に飲水のために起きる、虫歯が多くなったなど)を訴えます。
しかし、ドライアイの訴えで、内科を受診することはほとんどありませので、ドライマウスの診断の流れを考えて見ましょう。歯科口腔外科を訪れるドライマウスの患者さんの2割が、シェーグレン症候群と診断されています。残りの8割は、神経性、薬物性(向精神病薬など)ですから、服用中の薬剤などの情報もたいへん重要です
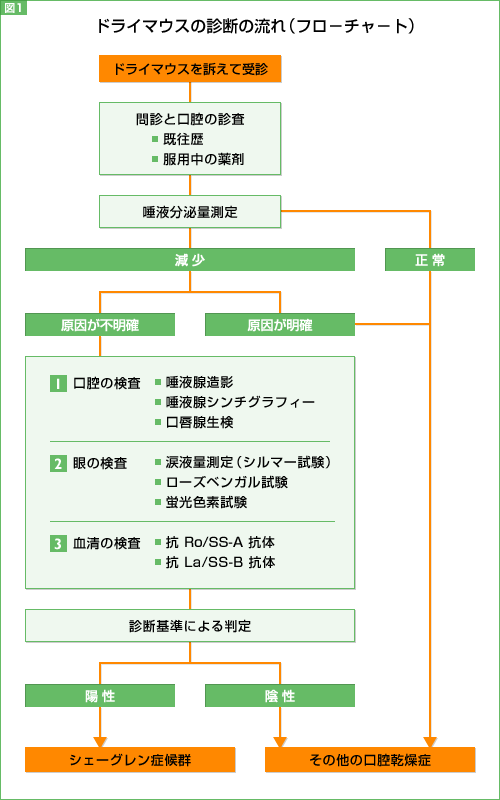

よって、ほとんどのドライマウスを起こす疾患は、シェーグレン症候群ではない疾患や薬剤や環境、職業などを原因とする乾燥症候群(syndromeSicca )に分類されるわけです。シェーグレン症候群の除外基準として、頭頸部の放射線治療の既往、C型肝炎、サルコイドーシス、抗コリン薬の使用などがあります。

抗コリン薬と口渇

唾液分泌のメカニズムは、ムスカリン受容体(M3)の刺激によって起こります。つまり副交感神経の興奮によって唾液が分泌されるというわけです。副交感神経終末から分泌されたアセチルコリン(ACh)が唾液腺のムスカリン受容体を刺激し、細胞内のカスケードが進み結果的には、カルシウムイオンの放出され、塩素イオンチャネルが開いて、塩素イオンの分泌に引っ張られたナトリウムイオンとが合わさり塩化ナトリウムとなり腺腔内の浸透圧が上昇し、それを薄めようと、アクアポリン(水チャネル)によって水が腺腔内に移動する水こそが「唾液」となるわけです。つまり、抗コリン作用とは、唾液の水生成のスタート地点を抑えるということです。
例えば、抗癌剤のエンドキサンや認知症薬のアリゼプとなどは、コリンエステラーゼ阻害作用があり、副交感神経を刺激するため、流涎(りゅうぜん)と呼ばれるよだれが垂れてしまう副作用があります。
他にも様々な薬が口渇の原因となります。ループ利尿薬やNSAIDsは、Na-K-Cl共輸送系を抑制し、水の生成抑制します。Ca拮抗薬やテオフィリン(キサンチン誘導体)は、膜細胞内のCa貯蔵庫からCaイオンの遊離を抑制(Ca濃度↓)して、水の生成抑制します。モルヒネなどのオピオイドもCaイオンチャネルを抑制して外分泌腺抑制します。
また、口渇は、口渇中枢というところも関係しています。口渇中枢には、ノルアドレナリン、グルタミン酸、ドパミン、オレキシン、γアミノ酪酸(GABA)など様々な神経伝達物質が関与していて複雑に調節されています。このことが、多くの薬によって喉の渇きがでる理由です。
薬の添付文書を見ると、700種類以上のお薬が口腔乾燥を引き起こす可能性ががあります。その中でも特に口渇の頻度が高いと思われる薬剤を挙げてみました。
合成抗ムスカリン作用薬 アトロピン、ガストロゼピン(胃酸分泌抑制)セルベックス、ムコスタ(胃薬)トランコロン(過敏性大腸症)ブスコパン(鎮痙薬)アーテン(抗パーキンソン薬)
抗うつ薬 トリプタノール(三環系)テトラミド(四環系)パキシル(SSRI)
抗精神病薬 セレネース、ドグマチール
抗ヒスタミン薬 ポララミン、アタラックス、アレグラ、タリオン等
尿失禁薬 ポラキス、バップフォー、ブラダロン
気管収縮抑制薬(抗コリン薬)アトロベント、テルシガン
利尿剤 フルイトラン、ラシックス、ダイアート
α2受容体刺激薬 アルドメット ワイテンス
ACE阻害薬 ARB阻害薬 レニベース ニューロタン、ブロプレス
抗不整脈薬 リスモダン
α1遮断薬 カルデナリン
Ca拮抗薬 ノルバスク、アダラート
スタチン系 メバロチン リピトール
筋弛緩薬 ミオナール、テルネリン
糖尿病薬 ベイスン
骨粗鬆症薬 アルファロール
H2受容体拮抗薬 ガスター、ザンタック、タガメット
プロトンポンプ阻害薬 オメプラール、タケプロン
制吐薬 プリンペラン、ノバミン
麻薬鎮痛薬 モルヒネ、オピオイド
ベンゾジアゼピン系 セルシン、ソラナックス、ドラール、ユーロジン、デパス
抗てんかん薬 テグレトール
抗パーキンソン薬 メネシット、マドパー、シンメトレル、ドバストン
抗がん剤 5−フルオロウラシル、テガフール
シェーグレン症候群の診断については、世界的に統一された基準はなく、日本では、厚労省基準が使われています。

しかし、生検や造影、シンチなどはもちろんのこと、シルマー試験とかサクソン試験とかは、誰かが専任でやらないと安定した結果なんか出そうにもありません。僕らプライマリーケア医は、乾燥症状があって、抗SSA抗体が陽性であれば、シェーグレン症候群(もどき)として治療?をしているわけです。こんなええ加減でいいんでしょうか? いいんです。
原発性シェーグレン症候群の病変は3つに分けることができます。
(1)ドライアイ、ドライマウスの症状のみがある患者さんで、ほとんどは、自制内で暮らしている患者さん(潜在性)ですが、医院を受診される患者さんは結構つらそうで、やはり乾燥症状に悩まされているということですよね。(約45%)
(2)唾液腺、涙腺以外の全身性の何らかの臓器病変を伴うグループで、諸臓器へのリンパ球浸潤、増殖による病変や自己抗体、高γグロブリン血症などによる病変を伴う患者さんです。(約 50%)
(3)悪性リンパ腫や原発性マクログロブリン血症を発症した状態です。(約5%)経過を見ますと、約半数の患者さんは 10 年以上経っても何の変化もありませんが、半数の患者さんは 10 年以上経つと何らかの検査値異常や新しい病変がみられます。

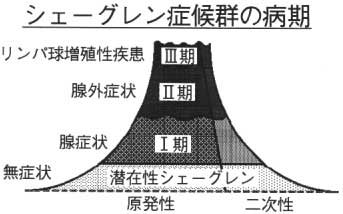
フライマリーケア医が見ている患者さんは、ほとんどは、Ⅰ期のドライアイ、ドライマウスの症状のみのシェーグレン症候群で、10~20年経ても症状に変化のない患者さんが約半数で、医療者側は、あまり根本的治療もなく、結構放っておいてもいいかなと思ってしまいがちでなのです。
経過については、残りの約半数の患者さんには何らかの検査値の異常や全身性の病変が発症する可能性があります。その中には白血球減少、高γグロブリン血症や皮膚の発疹、間質性肺炎、末梢神経症、肝病変、腎病変などがあります。まれにリンパ腫を発症する患者さんもいます。
Ⅱ期の腺外症状には、早期に起こるものと遅発性に起こる症状の2段階に分けられます。早期は、腺上皮にBリンパ球が浸潤して炎症を起こしているところからちょっと(1)Periepithelialに広がった病態で、関節炎や間質性腎炎、閉塞性細気管支炎などを起こします。ここまでは予後良好です。しかし、ここでも放っておくと約10%に(2)Extraepithelialな病態で、上皮のところでできた抗体が、全身を回って、免疫複合体が臓器に沈着しておこる遅発性の腺外症状が起こり、触知可能な紫斑、糸球体腎炎、末梢神経障害など、まさにSLEに似た病態になっており、予後が悪くなります。そして、悪性リンパ腫の合併です。
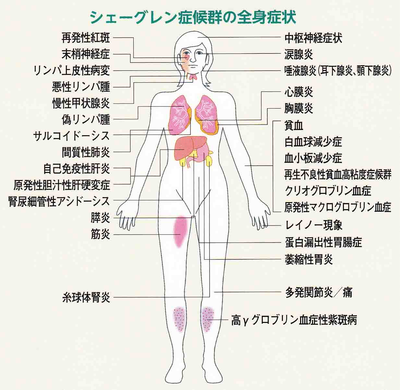
つまり、プライマリケア医として何をしたらいいのか、Ⅱ期(遅発性)を見逃さないように、専門医に紹介することです。腺外症状としては、息切れ、発熱、関節痛、毛が抜ける、肌荒れ、夜間の頻尿、紫斑、皮疹、レイノー現象、アレルギー、日光過敏、膣乾燥(性交不快感)疲労感(倦怠感が強い)記憶力低下、頭痛、めまい、集中力の低下、気分が移りやすい、うつ傾向などがあります。身体所見としては、耳下腺腫脹、リンパ節腫脹のチェック。検査では、高γグロブリン、C3低値(補体) IgGの上昇、クリオグロブリンなどをチェックします。
悪性リンパ腫が合併しやすい条件は、C型肝炎、C4低値 クリオグロブリン、唾液腺シンチが強陽性、唾液腺生検におけるGerminal Center Formationが見られるなどが上げられます。まあ、ドライアイ、ドライマウス以外の症状が出てきたら、定期的に専門医のフォローしてもらっておいたほうが無難でしょうか。
もうひとつ、原発性のシェーグレン病と思っていたら、膠原病に合併する二次性シェーグレン症候群だったってこともあります。関節リウマチの患者さんの約20%にシェーグレン症候群が発症します。他の膠原病のチェックもしておきましょう。
治療
一般論として、規則正しい生活、休養、バランスのとれた食事、適度の運動、ストレスを取り除く等の注意が必要です。
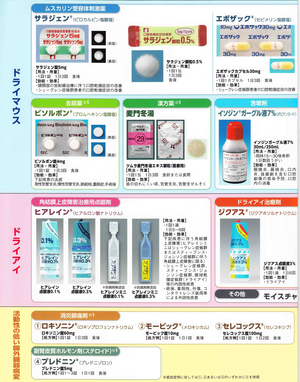
目の乾燥には、涙の補充(人工涙液)を毎日の点眼(1日3回以上)使用します。普通の点眼薬には防腐剤が入っていますので、何回も点眼するときは防腐剤の入っていない使い捨ての点眼薬(ヒアレイン・ミニ)を使う方が良いでしょう。涙の蒸発を防ぐ、眼鏡の枠にビニール製のカバーをつけたモイスチャー・エイド(ドライアイ眼鏡)があります。また、涙の排出を低下させるためには、鼻側の上下にある涙の排出口である涙点を閉じる方法(眼科医に相談)があります。
口の乾燥には、エアコン、飛行機の中、風の強い所、香辛料、アルコール飲料を避けること、禁煙などに注意が要ります。シェーグレン症候群の患者さんは虫歯になりやすいので、歯科と協働して、口内を清潔に保つことが非常に大切です。まず、口腔乾燥作用を持つ薬剤を服用しているときはこれを中止することです。唾液分泌を刺激するものとして:シュガーレスガム、レモン、梅干などがあります。薬剤としては、ビソルボン、人参養栄湯、麦門冬湯なども用いられます。サラジェン(副作用 多汗)唾液の補充には、サリベート(人工唾液)は、舌の上だけでなく、舌下、頬粘膜に噴霧。冷蔵庫保存で不快な味が消えます。

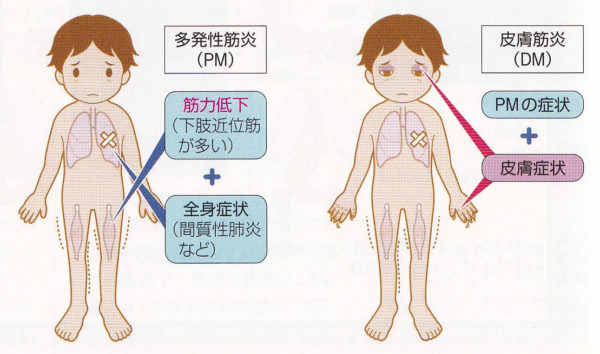
皮膚筋炎・多発性筋炎
皮膚筋炎・多発性筋炎は、筋肉の炎症により、筋肉に力が入りにくくなったり、疲れやすくなったり、痛んだりする病気です。他の膠原病と同じく、筋肉と皮膚の症状以外にも、関節痛は頻度が高く、肺も症状を起こしやすい臓器です。患者さんは、1万7千人と推定されています。(毎年1000〜2000人の方が新規に発症)男女比は、1:3で女性が多く、発症年齢は、中年発症が最も多いようです。(15歳以下が3%と小児期(5-14歳)も小さなピークがあり、60歳以上25%)
筋力の低下は、胴体に近い筋肉(近位筋)に現れやすく、階段を昇ったり、座った姿勢から立ち上がりにくい(スクワットができないかどうか)髪の手入れをしたり、洗濯物を干したりするような、肩より上に手を挙げるような動作がしにくいなどの症状が出ます。筋肉には炎症のため把握痛があり、血液検査では、CPK上昇(90%)を認めます。さらに、嚥下摂食障害をきたし、誤嚥性肺炎を繰り返すこともあります。
診断基準

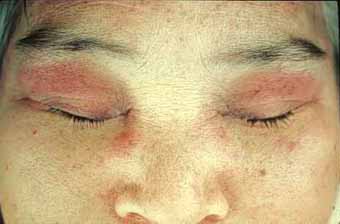
ヘリオトロープ疹
ヘリオトロープとはキダチルリソウという紫色の花の咲く植物のことです。目立つのは、まぶたに紫紅色の腫れぼったい皮疹が現れ、ヘリオトロープ疹と呼ばれています。他に、鼻唇溝、頭皮などにも紅斑が現れ、脂漏性皮膚炎と間違われることもあります。
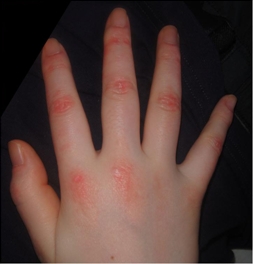
ゴットロン丘疹
手指の第二関節(PIP関節)や手指の付け根の関節(MCP関節)の手の甲の側に表面がかさかさして(落屑)盛り上がりを伴う紅色の皮疹が出来ます。さらに、手指以外にも、肘・膝・足首などの関節の伸側面に生じた紅斑を含めて広く「ゴットロン徴候」と呼んでいます。その他、首から胸にかけてや、肩のから上背部にかけての紅斑がでると、それぞれV徴候、ショール徴候と呼ばれます。これらの皮疹はかゆみを伴うことが多く、初めはかゆみだけで始まる方もいます。
皮膚筋炎の場合は、ヘリオトロープ疹やゴットロン丘疹(ゴットロン徴候)といった特徴的な皮膚症状があるので、診断基準上は問題ありませんが、多発性筋炎の場合は、後々、筋ジストロフィーとの鑑別が問題となる場合もあるので、原則、筋生検をしておくほうが無難(診断に必須ではない)だと思われます。
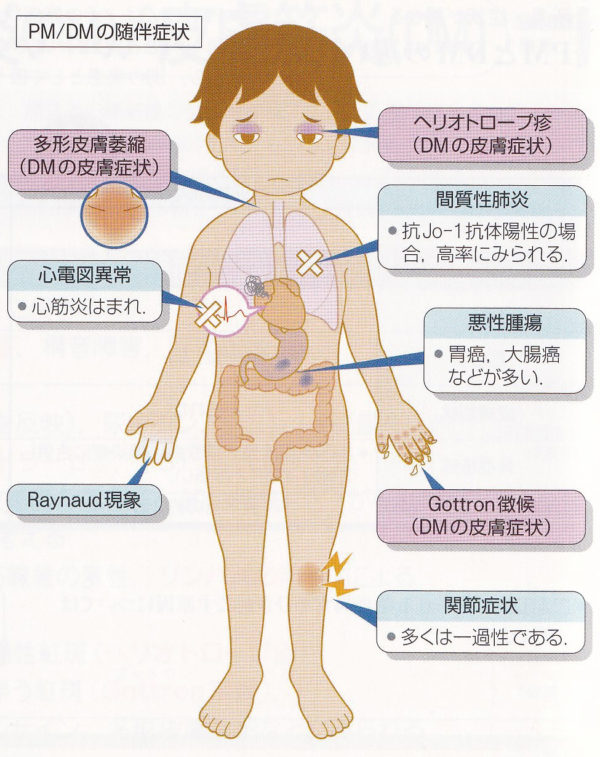
皮膚症状と筋症状以外では、まずは、関節症状(痛み、腫れ)がありますが、関節リウマチと違って腫れが長期間続いたり、関節が壊れるようなことは殆どありません。また、寒くなると手指や足趾が白く冷たくなるレイノー症状もよくありまが、強皮症と違って尖端に潰瘍ができたりすることも殆どありません。全身の症状として、倦怠感、疲労感、食欲不振などがあります。
合併しやすい病気のうち特に注意しなくてはならないのは間質性肺炎と悪性腫瘍(15%併発)です。喉の痛みや痰などがないのに頑固に咳が出たり、運動時の息切れなどの症状となります。特に、皮膚症状が強い皮膚筋炎(筋炎症状は乏しい)に合併する場合は、急速に間質性肺炎が進行する場合がありますので、出来るだけ早く治療しなくてはなりません。
悪性腫瘍も、特に皮膚筋炎で合併しやすいものです。治療開始時とその後2年間は癌の有無をよく調べる必要があります。生命が危機に瀕するのは、間質性肺炎や悪性腫瘍の合併例です。特に急速進行性間質性肺炎では、ステロイド治療と積極的な免疫抑制薬併用が救命できる可能性のある唯一の治療法と考えられています。死亡五大病因は感染症、膠原病増悪、心血管イベント、悪性腫瘍、間質性肺炎です。
皮膚筋炎、多発性筋炎は、症状が多彩なので、膠原病内科ばかりが診ているとは限りません。診断のきっかけががんのこともあり、間質性肺炎の場合もあります。
治療は、確立されたレジメンはありませんが、主に副腎皮質ステロイド薬(プレドニゾロン換算で1mg/日)が使用されます。重症例には、ステロイドパルス療法を併用することもあります。一般に、治療しても筋力は完全に戻るわけではありません。筋力の回復は発病後間もなく筋力低下の強くない方ほど良好(治療前の7〜8割)ですが、重症になるほど筋力の回復も悪くなります。なお、高齢者ほど、炎症鎮静化後も筋力低下が残る場合があり、筋再生を高めるには、現在のところ、リハビリしかありません。ステロイド療法は、9割以上の症例で有効で、大多数が日常生活に復帰します。しかし、ステロイド療法が無効の場合、副作用のため使えない場合などで、4割の症例で免疫抑制薬(イムラン、エンドキサン)も併用されています。特に、抗Jo-1抗体(抗ARS抗体)が陽性の人は、間質性肺炎、関節炎、レイノー症状、発熱などが多く、ステロイド単独で治療しても寛解は少ない場合が多いようです。
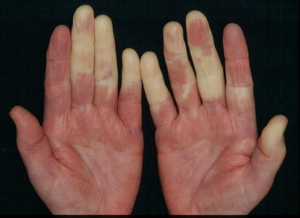
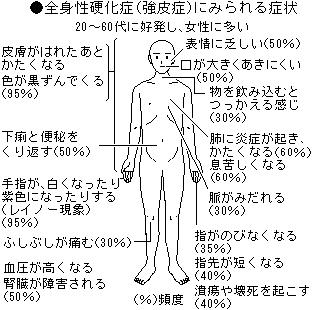
強皮症(全身性硬化症)
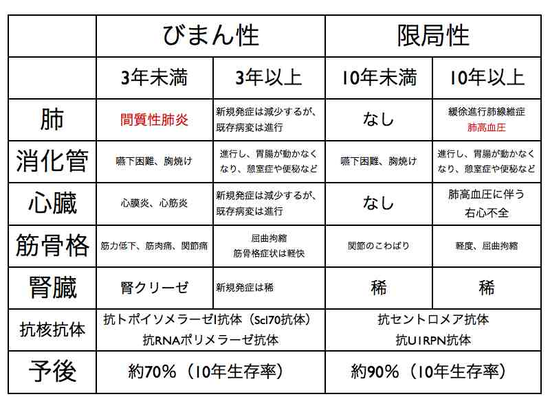
まず、この疾患については語句(診断名)の整理から説明します。強皮症と呼ばれている疾患には全身性硬化症(全身性強皮症)と限局性硬化症(全身性強皮症)があり、両者は全く異なる疾患ですので、この区別がまず重要です。限局性強皮症は皮膚のみの病気で、内臓を侵さない病気です。つまり、膠原病ではありません。限局性強皮症(モルフィア)の患者さんが、医師から単に「強皮症」とだけいわれて、全身性強皮症と間違えて不必要な心配をしていることがしばしばありますので、まずはここをしっかり押さえておいて下さい。
次に、膠原病の全身性硬化症は、「限局性皮膚硬化型全身性強皮症」と「びまん性皮膚硬化型全身性強皮症」とに分けられています。つまり、全身性なので、肺や心臓もやられますが、皮膚については、手足(肘より末梢、膝より末梢)だけが限局的に硬くなるタイプと、体幹も含めた全身性の皮膚がびまん性にやられるタイプがあるわです。
ややこしいですよね。さらに、昔は、進行性全身性硬化症と呼ばれていましたが、患者さんによっては病気はほとんど進行しない場合も珍しくないことから「進行性」という部分は使われなくなりました。全身性硬化症の進行や内臓病変を起こす頻度は患者さんによって大きく異なり、発症より5~6年以内は進行する患者さんもいれば、軽症では進行はほとんど進行しないか、あるいはゆっくりです。このどちらに当てはまるかによって、その後の病気の経過や内臓病変の合併についておおよそ推測ができるようになっています。
本邦での全身性強皮症患者は2万人とされていますが、その中には皮膚硬化がゆっくりとしか進行しない患者さんも多く、病気に気が付かなかったり、医療機関を受診しても診断されなかったりすることもしばしばあり、実際の患者数は数倍以上になると推定されています。男女比は1:12であり、30~50歳代の女性に多く見られます。(70歳以降の高齢者にも発症することもあり)
レイノー症状
全身性強皮症は、レイノー症状から発症することが多く、冷たいものに触れると手指が蒼白~紫色になる症状で、冬に多くみられ、初発症状として最も多いものです。治療としては保温が大切です。

レイノー現象
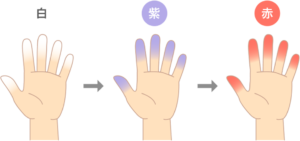
 指の色が、白 → 青(紫) → 赤 に変わる現象です。まず、血管が攣縮して、血が流れなくなると指が白くなります。指1本の第一関節から末梢だけとか、指2本だけとかいろいろなパターンがあります。酸素がなくなってチアノーゼになります。最後は、反射的に広がって赤くなります。
指の色が、白 → 青(紫) → 赤 に変わる現象です。まず、血管が攣縮して、血が流れなくなると指が白くなります。指1本の第一関節から末梢だけとか、指2本だけとかいろいろなパターンがあります。酸素がなくなってチアノーゼになります。最後は、反射的に広がって赤くなります。
原因は、薬物、化学物質 エストロゲン ニコチン シクロスポリン エルゴタミン
環境因子 凍傷 振動病
神経疾患 手根管症候群
甲状腺機能低下症 クリオグロブリン血症など
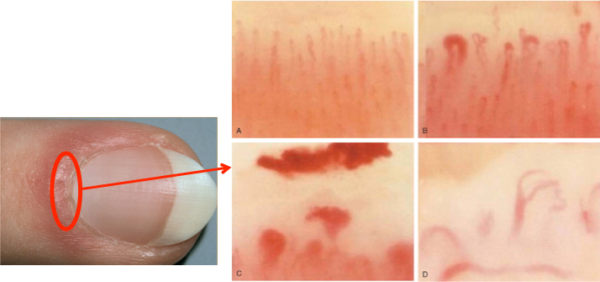
デルマトスコープで爪床毛細血管をみてみましょう。
A; 正常の毛細血管: 均等な毛細血管ループが密に認められる.
B; 拡張毛細血管
C; 点状出血
D; 血管狭小化, 消失
膠原病では異常がみられる。
レイノー症状を呈する膠原病
| 疾患 | 頻度(%) |
|---|---|
| 混合性結合組織病(MCTD) | 98 |
| 全身性硬化症(SSc) | 90 |
| 全身性エリテマトーデス(SLE) | 40 |
| シェーグレン症候群(SS) | 20 |
| 多発性筋炎/皮膚筋炎(PM/DM) | 10 |
| 関節リウマチ(RA) | 5 |
皮膚硬化
皮膚硬化は、典型的には手指の腫れぼったい感じで始まるので、つるつるしているので年齢より若く見えます。手のこわばりや急に指輪が入らなくなったことで気づかれることもあります。その後、手背、前腕、上腕、体幹と体の中心部分に皮膚硬化が進みます。しかし、限局皮膚硬化型全身性強皮症では体幹の硬化はきわめて稀です。
爪上皮(爪のあま皮)の黒い出血点、指先の少しへこんだ傷痕、指先や関節背面の潰瘍、毛細血管拡張、皮膚の石灰沈着、皮膚の色が黒くなったり、逆に黒くなった皮膚の一部が白くなったりする色素異常などがみられます。
肺線維症
進行すると空咳や息苦しさが生じ、酸素吸入を必要とすることもあります。「びまん型全身性強皮症」で比較的多く見られる合併症です。肺線維症があると肺炎を起こしやすいので注意が必要です。
肺高血圧症
限局皮膚硬化型全身性強皮症で肺高血圧症を起こすことがあります。他の膠原病でもMCTD SLEなどで合併します。以前は、効果的な治療法もなく、致死的でしたが、最近、プロスタグランジン、シルデナフィル、ボセンタン、イマチニブなどが使われるようになり、予後は改善してきています。
強皮症腎クリーゼ
腎臓の血管に障害が起こり、その結果高血圧が生じるものです。急激な血圧上昇とともに、頭痛、吐き気が生じます。ACE阻害薬という特効薬による早期治療が可能になって、現在はほとんど見られなくなりました。
逆流性食道炎
食道下部が硬くなり、その結果胃酸が食道に逆流して起こるもので、症状としては胸焼け、胸のつかえ、逆流感などが生じます。
全身性強皮症の経過を予測するとき、典型的な症状を示す「びまん型全身性強皮症」と比較的軽症型の「限局型全身性強皮症」が役に立ちます。「びまん型全身性強皮症」では発症5~6年以内に皮膚硬化の進行および内臓病変が出現してきます。不思議なことですが、発症5~6年を過ぎると、皮膚は徐々に柔らかくなってきます。つまり、皮膚硬化は自然に良くなるのです。しかし、内臓病変は元にはもどりません。ですから、発症5~6年以内で、できるだけ早期に治療を開始して、内臓病変の合併や進行をできるだけ抑えることが極めて重要なのです。一方「限局型全身性強皮症」では皮膚硬化の範囲も狭く、例外を除いて重篤な内臓病変を合併することはありませんので、症状を抑える治療法(対症療法)が主体となります。
「びまん皮膚硬化型全身性強皮症」と「限局皮膚硬化型全身性強皮症」を区別する最も大切な目印は、自己抗体の種類です。抗トポイソメラーゼI(Scl-70)抗体や抗RNAポリメラーゼ抗体は「びまん皮膚硬化型全身性強皮症」の目印であり、一方、抗セントロメア抗体は「限局皮膚硬化型全身性強皮症」の目印となります。