我々の世界で、最も重篤な不整脈は、心室細動(医療系ドラマでは必ず出てくる)ですが、机上で勉強してわかりましたって種類の心電図所見ではありません。日常診療で極めて稀であり、一生会わない医師もたくさんいるでしょう。丸暗記なんてなんの意味もありません。実践がすべてです。心電図がはっきり読めなくても、意識がなければ、なにか変?って臭いをかぎ分けて、「除細動!」なんてことが、出来るかどうか。カテ屋さんで心筋梗塞ばかり見ていると年に数度は、そういった修羅場に出くわしているわけです。
それぞれの不整脈の診断と治療をお話しする前に抗不整脈薬の使い方について述べておきます。抗不整脈薬を効果的かつ安全に使用するには、治療対象とする不整脈の診断だけでは不十分で、患者背景を考慮した診断(例えば、健常心における心室性期外収縮とか、陳旧性心筋梗塞による低心機能例における発作性心房細動など)が必要です。虚血性心疾患や心筋症などの器質的心疾患、うっ血性心不全が存在する例では、抗不整脈薬の催不整脈作用が出現し高度徐脈や致死的な心室性不整脈が発生することがありますし、基礎心疾患以外でも、高齢・電解質異常・肝腎臓機能障害などは、抗不整脈薬の催不整脈作用を発現させる要因になります。例えば,高齢者では潜伏する洞不全や房室伝導障害が、抗不整脈薬の投与により顕在化することも少なくありません。また、高カリウム血症では洞不全が、低カリウム血症ではQT延長からtorsades de pointes (TdP)型の心室頻拍が惹起されやすいのは有名です。肝腎機能低下例では抗不整脈槃の血中濃度上昇により致死的な心室性不整脈や心停止が生じることがあるなど、患者背景の理解が不整脈の治療方針や抗不整脈薬の選択を左右することを理解しておくことは大切です。
上室性期外収縮
上室性期外収縮は、日常診療で最も多く認める不整脈です。ホルター心電図の記録で、心房性期外収縮と心室性期外収縮を認めないのは、1/300以下です。つまり99.7%以上は期外収縮を認めるわけで生理的な現象と考えたい。心房性期外収縮は加齢とともに増加します。心血管系の死亡率とは無関係であると報告されています。高血圧や貧血、脱水、睡眠不足、ストレス、過度なアルコールなどがないかチェックしてみましょう。「心配ないこと」ことを説明し、生活習慣を見直す様に指導します。
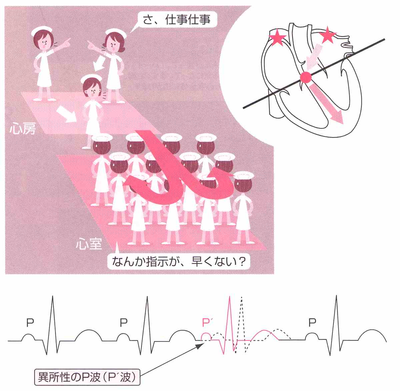
期外収縮とは、本来予想されていた(期待されていた)タイミングよりも早く収縮が起こることを言います。本来の洞結節(内科師長から出た命令)から起こった収縮ではないため、異所性の興奮(他の病棟の師長が出した命令)でP波の形が異なっています。つまり、心房から発生した電気刺激で、洞結節からの規則正しいリズムから逸脱して、やや早いタイミングで心臓の収縮が起こった不整脈を上室(心房)性期外収縮といいます。上室(心房)性期外収縮は、ほとんどの方が自覚症状がないことが多く、健康診断ではじめて指摘されることもめずらしくありません。原因は、睡眠不足や過労、精神的、肉体的ストレス、たばこなどが引き金になっていることが多く心配ありませんが、 頻発するようなら、まれに心疾患を伴う場合もありますので、原因の病気がないかを一度は調べてもらったほうがよいでしょう。
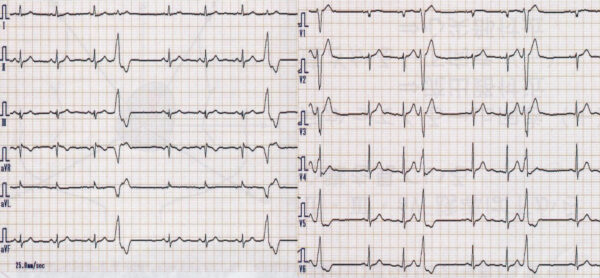
期外収縮は上室性期外収縮と心室性期外収縮に分類されるが、接合部性も含めて上室性と表現されることが多い。上室性期外収縮が房室結節から心室に伝導する際に右脚や左脚(主に右脚)で伝導の遅れが生じるとQRS波は変形し、心室性期外収縮のような波形を呈する(変更伝導)ことがあります。不整脈診断の第一歩はP波を確認することです。上室性期外収縮であれば、QRS波に先行するP波がT波に重なりT波の変形として現されることが多い。次の心電図では、上室性期外収縮の変行伝導(左脚ブロック型、右脚ブロック型)さらにbloced PAC(上室性期外収縮の出るタイミングが早すぎて、不応期に重なり、伝導されなかった)が続いて出ています。反対に、心室性期外収縮であればQRS波の後に逆行性のP波があるということで鑑別に役立ちます。
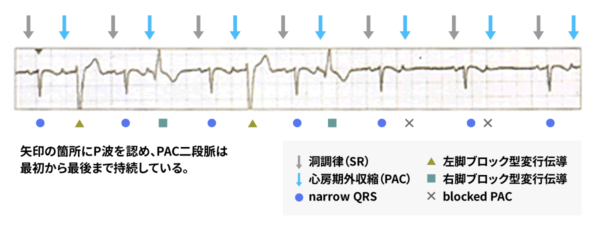
治療
基礎心疾患のない場合、自覚症状がないものは治療を必要としない。(上室性期外収縮の数を減少させる目的での薬物治療は必要ありません)自覚症状があるものはβ遮断薬を第ー選択とし、若い人で神経質そうだなと思った時はリーゼ5mg/日を使っています。基礎疾患のある場合でも、自覚症状がないものは期外収縮が頻発し、血行動態に悪影響を及ぼしているなどの状況がなければ、一般には抗不整脈薬による治療は行いません。自覚症状があるものは、心機能低下が中等度以なら心機能低下に対する治療を優先します。心機能低下が軽度なら、第ー選択は、β遮断薬としてビソプロロール(1回2.5 mg 1日1〜2回)が使いやすい。
第二選択は、抗不整脈薬を使用します。心の中ではここに線を引いています。ピルジカイニド・シベンゾリンなどのNaチャネル拮抗薬の少量から投与(ピルジカイニドでは1回50 mg 1日2回、シベンゾリンでは1回1OOmg I日2回)し、様子をみながら通常量へと増量していくのですが、患者さんによってはここまではなんとか処方しています。これでも効かないとなるとプロパフェノン(1回150mg I日2回)などのNaチャネル拮抗薬を使用する場合は、日赤に紹介しています。
心室性期外収縮
上室性期外収縮と同じように、心室性期外収縮も、日常診療で最も多く認める不整脈です。ホルター心電図の記録で、心房性期外収縮と心室性期外収縮を認めないのは、1/300以下です。つまり99.7%以上は期外収縮を認めるわけで生理的な現象と考えたい。
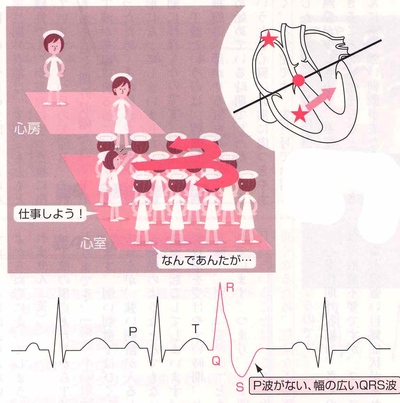
期外収縮とは、本来予想されていた(期待されていた)タイミングよりも早く収縮が起こることを言います。本来の洞結節(内科師長から出た命令)から起こった収縮ではないため、異所性の興奮(内科病棟のスタッフのひとりが勝手に出した命令)でP波がありません。つまり、心室から発生した電気刺激で、洞結節からの規則正しいリズムから逸脱して、やや早いタイミングで心臓の収縮が起こった不整脈を心室性期外収縮といいます。心室性期外収縮は、ほとんどの方が自覚症状がないことが多く、健康診断ではじめて指摘されることもめずらしくありません。原因は、睡眠不足や過労、精神的、肉体的ストレス、たばこなどが引き金になっていることが多く心配ありませんが、まれに心疾患を伴う場合もありますので、期外収縮があるといわれたら、原因の病気がないか、また期外収縮から危険な不整脈に移行する可能性がないかを一度は調べてもらったほうがよいでしょう。
治療
基礎心疾患のない場合、自覚症状が軽度であれば一般に薬物治療は行いません。(心室性期外収縮の数を減少させる目的での薬物治療は必要ありません)自覚症状が中等度以上でQOL低下のある場合には治療をします。
基礎疾患があるないに関わらず、自覚症状が中等度以上の例では、心機能低下が中等度以上なら第ー選択としてNaチャネル拮抗薬のメキシレチン(1回100mg 1日2〜3回)を用います。神経質そうだなと思った時はリーゼ5mg/日も使っています。
基礎心疾患のない特発性の心室性期外収縮のうち、右脚ブロック、左軸偏位を呈するもの(左脚後枝Purkinje領域起源)はCaチャネル拮抗薬のベラパミミル1回40mg 1日2〜3回が有効である。
心の中ではここに線を引いていますが、基礎心疾患のない場合は、頑張ってもうひと踏ん張りして、特発性の心室性期外収縮のうち、左脚ブロック下方軸を呈するもの(右室流出路起源)では,β遮断薬やβ遮断作用を有するNaチャネル拮抗薬のプロパフェンを第ー選択とし、第二選択はCaチャネル拮抗薬のベラパミル、これらが無効な場合はシベンゾリン・ピルジカイニドなどのNaチャンネル拮抗薬を使用します。(用量は上室性期外収縮と同様)
 ;
;
ここからは、完全に紹介します。第二選択としてKチャネル拮抗薬のアミオダロン(1回50〜200mg1日1回(道入時は1回400mg 1日1回を1〜2週間))心機能低下が軽度以下ならKチャネル拮抗薬のソタロール(1回40〜80mg 1日2回)も使用可能です。非持続性心室頻拍のある例ではアミオダロンが推奨される。非虚血性の心筋症や弁膜症を基礎心疾患とする場合、心機能低下例では心筋梗塞と同様に薬剤を選択し、心機能低下のない例ではシベンゾリン・ビルジカイニドなどのNaチャネル拮抗薬を第ー選択とする(用量は上室性期外収縮と同様)より有効性の高い、フレカイニドやプロパフェンもあります。
急性心筋梗塞の急性期ではLown分類2度以上(頻発性・多源性・連発性・RonT)で心室頻拍・細動の危険性が高いと判断される場合には静注薬としてKチャネル拮抗薬のアミオダロンが選択されます。急性心筋梗塞の急性期以降は,自覚症状が軽度で3連発未満の期外収縮であれば一般に薬物治療は行いません。(急性心筋梗塞の急性期以降の心室性期外収縮ではNaチャネル拮抗薬による生命予後改善のエビデンスはなく長期使用は避ける)

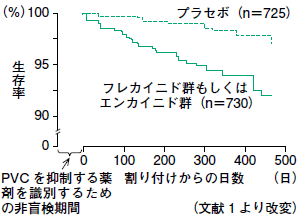
CAST Study
この試験は心室性不整脈のある心筋梗塞後の患者さんを対象として抗不整脈薬投与群とプラセボ群とを比較しました。当時最も強力で新しい抗不整脈薬であったフレカイニドやエンカイニドなどのIc群抗不整脈薬は見事にすべての不整脈を抑制したにもかかわらず、1年後の死亡率が著しく増加しました。つまり、不整脈を治療した方がたくさん死んだという衝撃的なものでした。
この意外な結果がいかなるメカニズムで生じたのか様々な検討が行われました。興味深いのは、抗不整脈薬投与群の死亡率は、Q波梗塞では、プラセボ群の1.7倍に対し、非Q波梗塞では8.7倍にのぼっていました。突然死発生の日内分布が虚血イベントの分布に近似していたことや非Q波梗塞の方が残存心筋が豊富であるため、抗不整脈薬投与群と急性虚血との関係が心事故発生と関係している事が推測されました。Ic群はその薬理作用からtorsades de pointesは起こりにくく、実際に抗不整脈薬投与群におけるホルター心電図でもtorsades de pointesの増加はなく、CAST試験の結果を催不整脈作用によってのみ説明する事はできないとしています。Ic群は、年齢、器質的心筋障害の有無および心機能に留意するだけで、多くの頻拍性不整脈を安全に使用でき、その卓越した薬効のゆえに現在の不整脈治療には欠かせない薬剤です。
発作性上室性頻拍
発作性上室性頻拍:narrow QRS tachycardia(幅の狭いQRSで規則的な頻拍症)は、房室回帰性頻拍、房室結節回帰性頻拍、心房頻拍に分類されます。
(1)房室回帰性頻拍 かの有名なWPW症候群で、房室結節を順行しケント束を逆行する上室性頻拍で、P’波はQRS波から離れてその直後に認められる。
(2)房室結節回帰性頻拍 房室結節付近に二重伝導路が存在し、これをリエントリー回路とする頻拍を生じる。
(a)common type 順行路として遅伝導路、逆行路として速伝導路となり、心房と心室の興奮の時相はほぼ同時となり、P’波を全く認識できない(48%)かP’波が、QRS波直後に認めらる偽性R’波、偽性S波を生じる(46%)稀にP’波が、QRS波直前に認める偽性q波を生じる。(2%)
(b)uncommon type 稀ではあるが、逆回転で、順行路として速伝導路、逆行路として遅伝導路の場合は、逆行性のP’波は、QRS波からかなり離れた部位に出現し、long RP’ tachycardia(RP’>P’R)が認めらる。
(3)心房頻拍
(a)心房内理エントリー
(b)異所性自動亢進

リエントリー
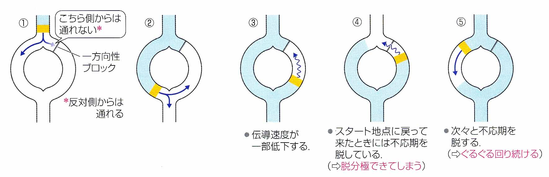
不整脈を起こす原因のひとつに、リエントリー(副伝導路)と呼ばれる機序があります。正常な心臓は、一本の指令系統で動いていますが、正常な刺激伝導系とは別に、もう一本の伝導路が存在することがあります。これを副伝導路と呼びます。この副伝導路に、一方向にしか流れない性質と伝導がゆっくりになる性質があると、いつまでも電気信号がぐるぐる回り続けてしまうようなことが起こり、頻脈性不整脈になってしまうのです。
治療
心房細動
心房細動中の心拍数は心房の興奮が房室結節を伝導し心室を収縮させた心室応答数であり,その速さは房室結節の伝導性のよし悪しに左右される。緊張や不安、発熱、低酸素状態、脱水、貧血、低心拍出、甲状腺機能充進状態などにより房室結節の伝導性は充進し心房細動レートは速くなる。逆に房室結節が伝導障害をもつ例では、心房が細動状態であっても心室応答数は上がらずレートの遅い心房細動を呈する。
心房細動の治療は,心拍数の調整を目標とするレートコントロール治療と洞調律の維持を目標とするリズムコントロール治療とに分けられる。発作性あるいは症候性の心房細動ではリズムコントロール治療をめざし、無症候性の持続性心房細動はレートコントロール治療で管理する。レートコントロール治療は房室結節の伝導を抑制するCaチャネル拮抗薬、β遮断薬が使用される。
心房細動にNaチャネル拮抗薬のIc群薬を用いる場合、5〜20%の例で心房細動の粗動化をみる。Ic 群薬により発生した心房粗動は粗動の周期が長いため、1: 1の房室伝導が可能となり非常に速い心拍数を生じることがあるので注意が必要である。持続性心房細動における洞調律の回復と維持については専門医に相談するのが無難である。
症候が強い、あるいは心拍数の速い心房細動では、まずレートコントロール治療を行い、これで症候が改善されない場合に心房細動の停止を考える。うっ血性心不全がある場合もレートコントロール治療で初期治療にあたるのが無難であろう。発生時期が不明の心房細動では、心房細動の停止後に塞栓症を発症する可能性があるため、レートコントロール治療が原則と考える。心房粗動は一般に薬理学的な停止が難しく、血行動態の不安定な症例ではDCによる洞調律の回復を考える。血行動態が安定している例では上記の心房細動の場合と同様にレートコントロール治療を行う。
高齢者では洞機能不全が潜在する可能性を念頭におく必要がある。洞機能不全があると心房細動の停止時に洞停止が生じ、ときにロングポーズとなり失神などをきたす(催不整脈作用による徐脈頻脈症候群)高齢者の心房細動患者を治療する場合には、抗不整脈薬は少量から開始し、導入が済んだらホルター心電図検査を行い徐脈性不整脈の有無を確認するといった診療が必要と思われる.
孤立性の発作性心房細動のリズムコントロール治療ではNaチャンネル拮抗薬を使用する。Naチャネル拮抗薬は、心房細動のトリガーとなる期外収縮を抑制すると同時に心房細動が持続する機序をも抑制するため、心房細動の予防にも停止にも有効である。Naチャンネル拮抗薬は少量から投与を開始し、様子をみながら通常量へとていく。基質的心疾患のある発作性心房細動のリズムコントロール治療については専門医に相談すべきである。心房粗動では薬物治療でなくカテーテルアブレーション治療による再発予防が第ー選択である。
心房粗動
心房粗動は心房頻拍と心房細動の間に位置する上室性頻拍で、右房内のマクロリエントリーを機序とする(通常型心房粗動)心拍数は2:1の房室伝導により、150/分前後を呈することが多く動悸症状が強くなることが多い。血栓塞栓症の合併は心房細動より少ないが発生しうるとされる。
心房粗動では房室伝導比が2:1から3: 1あるいは4:1へと段階的に低下しながらレートがコントロールされるため、より高用量の抗不整脈薬を要する例が多い。WPW症候群における心房細動ではベラバミルやジギタリスが禁忌である。副伝導路を抑制するKチャネル遮断作用のあるNaチャネル拮抗薬(ジソビラミド(50mg/5-10分)やシベンゾリン(70mg/5分)の静注によりレートコントロールする。症候が軽く心拍数が速くない場合(心拍数100~ 120/分程度)必ずしも静注薬を使用する必要はなく、内服薬で経過観察し翌日の外来診療に移行することも多い。Caチャネル拮抗薬のベラパミル1回40mg1日2〜3回やジルチアゼム徐放カプセル1回100 mg 1日1〜2回,β遮断薬のビソプロロール1回2.5mg 1日1〜2回などが使いやすい。良好な心拍数は、安静時で80/分未満、活動時で110/分未満、運動時で150/分未満とされる。
心室頻拍
心室頻拍は基礎心疾患や頻拍レートによっては、血行動態の破綻をきたし、致死性となることのある不整脈である。低心機能例では、失神や突然死の原因となるため、不整脈の診断にとどまらず基礎心疾患の精査が必要とされる。基礎心疾患としては心筋梗塞、心筋症、心臓手術後などが多いが、特発性や抗不整脈薬による催不整脈作用により出現するものもある。治療方針は血行動態の破綻があるかないかにより決定する。血行動態が破綻ないしは不安定な例ではDCを行う。頻拍レートが速くても血行動態の安定は薬物治療を行うことが多い。DC後も心室頻拍が再発する場合は、Kチャネル拮抗薬のアミオダロンやニフェカラントの静注を行い、再度DC治療を試みる。
基礎心疾患のない特発性 VT の発生部位でもっとも多いのは、左脚ブロック+右軸偏位(下方軸)を示す VT で、いわゆる流出路起源 VT として分類される。その機序は,おもに異所性自動能,もしくは撃発活 動とされ、長時間持続することはまれで、短時間の非持続 性 VT を繰り返すことが多い。したがってCa 2+ 電流を抑制する薬剤(β遮断薬、非ジヒドロピリジン系 Ca 拮抗薬)がおもに用いられるが、無効な場合は,心機能,肝・腎機能が維持されていれば、プロパフェノンなどの I 群抗不整脈薬(Na+ チャネル遮 断薬)が有効なこともある。
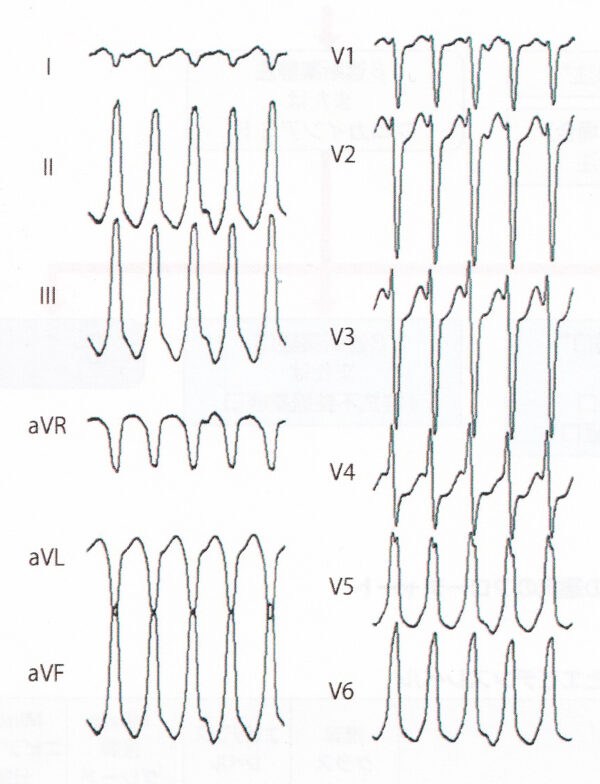
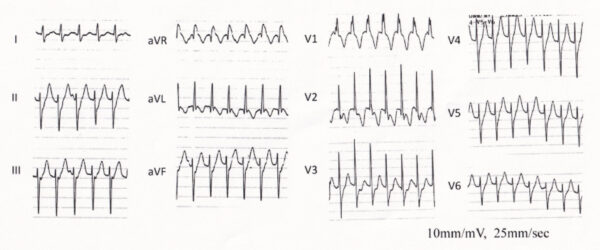
右脚ブロック+左軸偏位を示す特発性 VT は、上室頻拍の変行伝導も考えられるが、右軸偏位が多い。V5、V6のQRS波形のR/S比が1以下で、心室頻拍に特徴的な所見である。Ⅱ、Ⅲ、aVFは下向きの上方軸であり、流出路起源は考えにくい。したがって、診断は左脚後枝領域起源の特発性心室頻拍である。左脚後枝領域の心室頻拍にはベラパミル感受性のものがあり、左室起源特発性心室頻拍(ベラパミル感受性心室頻拍)と呼ばれる。若年男性に多く、再発を繰り返すものの一般的に予後良好な心室頻拍で、カテーテルアブレーションによって根治可能である。左脚後枝領域のプルキンエ網におけるリエントリー性頻拍の可能性 が高い。ベラパミルによる頻拍の停止、予防が 可能であり、ベラパミル感受性の有無を確認する必要がある。血圧低下に注意を払いつつベラパミル 5 mg をゆっくり静注する。頻拍が長時間持続している場合、内因性カテ コラミンの影響によりベラパミルの効果が得にくいことがある。ベラパミルが無効な場合は、後乳頭筋を起源とする巣状興奮パターンをとる VT を念頭におく必要がある。このような場合はβ受容体遮断作用があり、Ca 2+ 電流を抑 制するβ遮断薬の静注を考慮する。上記のような特異的な波形が認められない特発性心室頻 拍においては、エビデンスはないがβ遮断薬あるいは I 群 抗不整脈薬が停止および予防に使用されている。
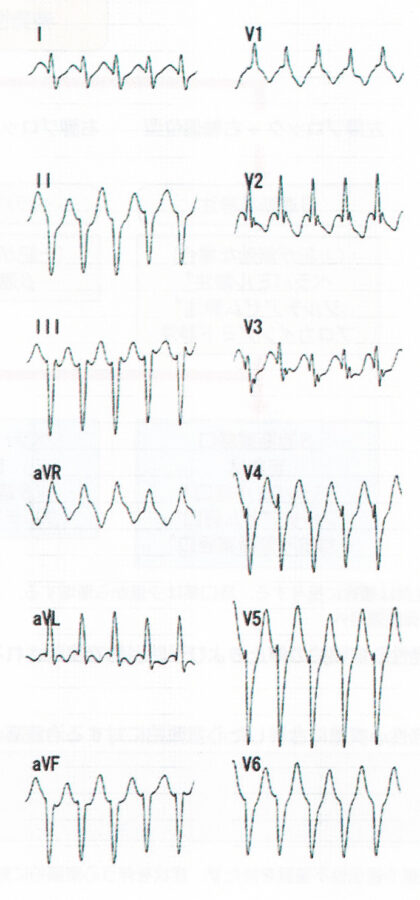
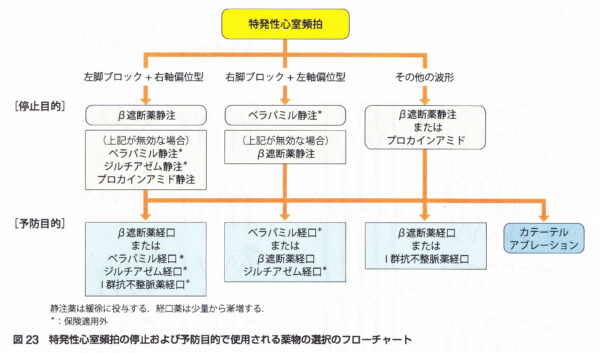
非発作時の心電図は正常。発作時の心電図はwide QRS頻拍であり、鑑別としては変行伝導を伴う上室性頻拍と心室頻拍が挙げられる。頻拍発作時の心電図のwide QRS頻拍は、右脚ブロックパターンで左軸変位型の心室頻拍を認める。経過中,発作時にベラパミルを静注したところ 頻拍の停止を認めた。心エコーでは器質性心疾患を認めず冠動脈も造影検査で異常所見を認めない。電気生理学的検査では,右室心尖部刺激にて頻拍が誘発された。その頻拍の心内マッピングにて最早期は左室中隔と判明した。また同部でのペースマップは自然発作時の心電図と完全に一致していた。以上から,左室起源特発性心室頻拍と診断した。同部位へのカテーテル焼灼術により,頻拍は誘発されなくなった。ベラパミル感受性心室頻拍の中で右脚ブロック+左軸偏位を示す左脚後枝領域心室頻拍は約90%と最も多く見られ,common typeと呼ばれる。本症のリエントリー回路は心内膜側にあり、発作の根治にカテーテルアブレーションが有効である。若年の男性に多く比較的予後は良好であるとされている。特発性の心室性期外収縮のうち、右脚ブロック、左軸偏位を呈するもの(左脚後枝Purkinje領域起源)はCaチャネル拮抗薬のベラパミミル1回40mg 1日2〜3回が有効である。
心筋細胞の電気生理
さっぱりわかってない人が、抗不整脈薬の薬理作用をこじつけで憶えるために、メモ書きしているところなのでここは読み飛ばしてもらっても構いません。
心臓って心筋細胞が収縮してポンプ機能というだけで単純ですがうまくできてますよね。機敏に全体が同時に働けるシステムは電気しかありません。心臓が電気活動をして、心筋細胞の起電力は100mVです。体表面心電図で記録出来る電位はかなり減衰して1mVに過ぎません。
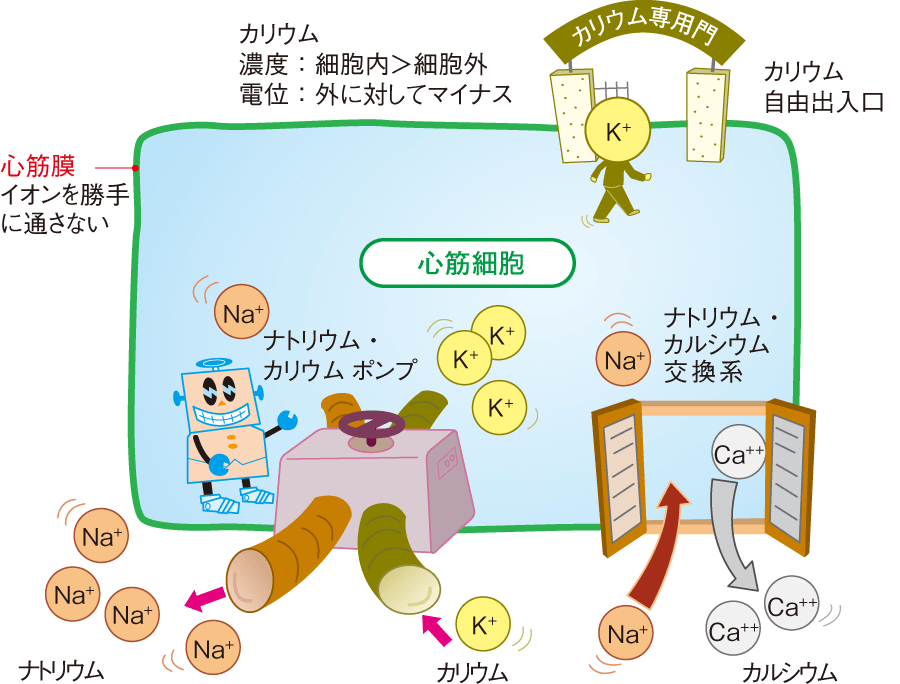
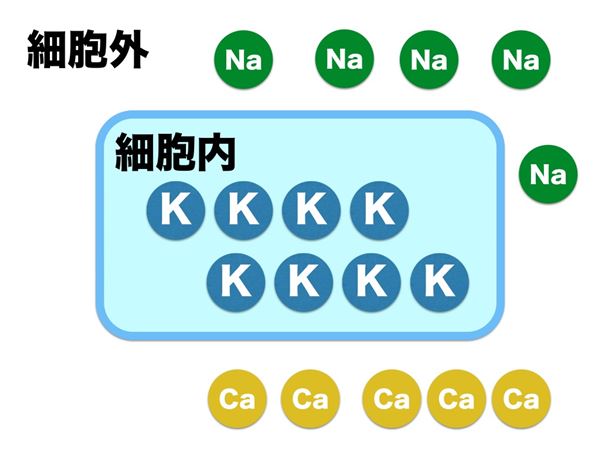
細胞が興奮し収縮するという現象の根源に静止膜電位、つまり細胞内外のイオン濃度勾配に依存します。まず、ここでつまずきますよね。最初からさっぱり意味がわからないので、その上にいろいろ重ねても砂上の楼閣ですよね。そもそも生体は海に生息しやがて陸にあがったという説から体内の細胞の外に豊富に存在する電解質は海水と同じNaですなんてお話になんとなく納得させられている感じで行きましょう。細胞内外で電位差をつくるなら、このナトリウムを細胞外にくみ出してしまえば簡単です。ちなみに細胞膜はイオン類を勝手に通さないようにできています。細胞膜には、Na、K、Caそれぞれのイオンを汲み出したり取り込んだりするしくみを備えてるわけです。(実は高校生物で習っているようです)ナトリウムを外にくみ出すと同時にカリウムを細胞内に引き込むシステムはナトリウム・カリウムポンプといい、このポンプは働き続けるポンプで、エネルギーを使って、常にナトリウムをくみ出して、カリウムを取り込み続けています。このポンプのおかげで細胞内は細胞外に比べてナトリウムが少なく、カリウムが多いという環境をつくり出します。しかし、このままでは、細胞内にカリウムが増えすぎてしまうため、細胞膜にはカリウムだけが通過できる出入り口がつくってあります。この穴を通ってカリウムは出入りしますが、濃度の差からいうと細胞内は濃くて、細胞外は薄いので外に出たがるし、電位でいうと細胞内はナトリウムがくみ出されて少ないのでプラスイオンが少なく、細胞外に対してマイナスになっていますから、プラスの性質のカリウムは細胞内に入りたがります。この出入りのバランスがとれている状態が平衡状態です。
もう1つ、心筋の収縮に重要な役割を果たすのが、カルシウムです。カルシウムにも細胞内外の濃度差が必要で、細胞内は少なく、細胞外には多くしてあります。ナトリウムを取り込み、カルシウムをくみ出すナトリウム・カルシウム交換系というシステムがあります。
①ナトリウム・カリウムポンプによる、ナトリウムのくみ出しとカリウムの取り込み
②カリウムの自由出入り口
③ナトリウム・カルシウム交換系による、ナトリウムの取り込みとカルシウムのくみ出し
主にこの3つのシステムによって、細胞内は細胞外に対して、ナトリウムとカルシウムの濃度は低く、カリウム濃度が高く保たれています。絶対量としては、ナトリウムが圧倒的に多いので、細胞内外の電位差はナトリウムが大きく影響していて、細胞外にプラスイオンが多く、細胞内に少ないという状態ができて、細胞内の電位が低くなります。この電位を静止膜電位(静止電位)といい、細胞内は細胞外に対して-90mVのマイナスの電位に保たれます。結局、いろいろな仕掛けを駆使してつくったイオンの細胞内外の濃度差は、この電位差をつくるためともいえます。
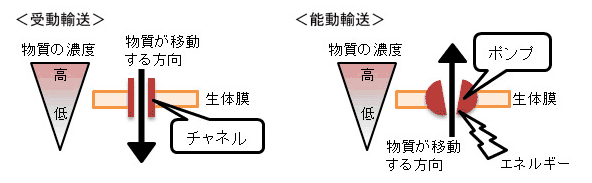
もう一つ大事なことは、Na、K、Caイオンの出入りに、チャンネルとポンプがあるということです。チャンネル(チャネル)は濃度勾配によって移動するためエネルギーはいりません。一方でポンプは濃度勾配に逆らって移動させるのでATPなどのエネルギーを使って逆方向へ移動させています。心筋細胞を興奮させる静止膜電位(−90mV)から正電位にすばやく移行(脱分極)させるNaチャンネルは、細胞外にある多量のNaがこのチャンネルを通ってNaの少ない細胞内に流入するわけでこれは、エネルギーを必要としない受動輸送です。この際、大量のNaが細胞内に流入したわけです。細胞は、元の状態に戻って、再度興奮するためには、それまでに細胞内に流入したNaをポンプ(エネルギー)を使って積極的に細胞の外に排出しなくていはなりません。これが、Na-Kポンプです。
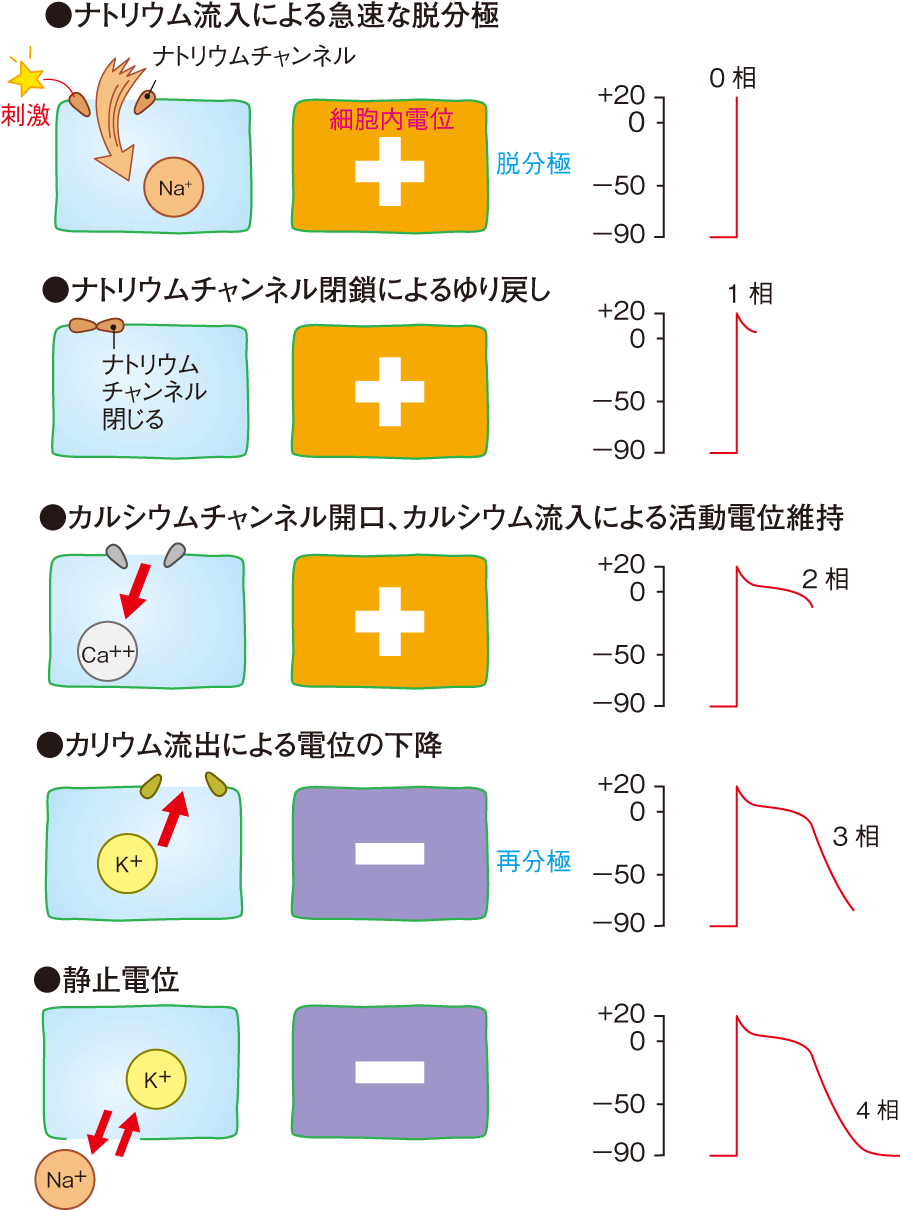
心室固有心筋の活動電位波形は、電気刺激によって閾値に達し、ナトリウムチャンネルが開いて、大量のナトリウムが流入し、電位が急峻に上昇します。これを0相といいます。開いたナトリウムチャンネルは、すぐ閉じて、電位が少し下がります。ここが1相です。ほぼ同時にカルシウムチャンネルが開いて、カルシウムが流入し、活動電位を保ちます。この平らな部分を2相とよびます。カルシウムの流入が終わるとカリウムチャンネルによって、細胞内からカリウムが細胞外に流出して、電位は静止電位に向かって下降していきます。これを3相といいます。電位を下げながら、ナトリウム・カリウムポンプでカリウムを細胞内に戻し、ナトリウムを細胞外に出して、静止電位に回復つまり再分極します。この静止電位を4相といいます。
(1)ナトリウム(Na)チャンネル
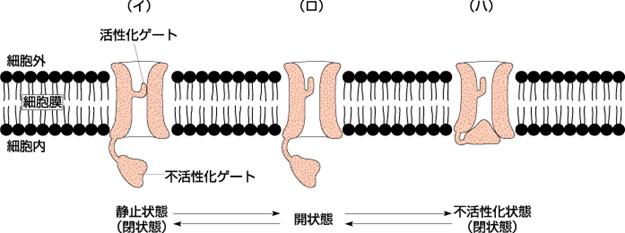
心筋が興奮するという現象は、細胞内電位が負の静止膜電位(−90mV)から正電位にすばやく移行(脱分極)させるために、生体では細胞外にもっともたくさん存在する陽イオンであるNaを細胞内に取り込むことで行っています。Naチャンネルは、Naイオンを細胞外から細胞内に通すポリペプチドの孔です。静止時には活性化ゲートは閉じて不活性化ゲートは開いている状態です。
(イ)刺激に基づいてNaチャンネルが活性化されると活性化ゲートが開き多量のNaがこのチャンネルを通って細胞内に流入して
(ロ)脱分極され電位がゼロになるとチャンネルの不活性化ゲートを閉じてNaは通れなくなります。
(ハ)いったん不活性化ゲートが閉じると一定の時間が経たないと再び孔を開くことができない時間があります。(不応期)その後、再分極されて不活性化ゲートが開いて活性化ゲートが閉じて元の状態(イ)に戻る。
Naチャンネルは、心筋が興奮する上で最も重要なチャンネルであり、多くの抗不整脈薬がNaチャンネルを修飾することによって心筋の興奮を抑制し、その結果として抗不整脈作用を発揮します。
(2)カルシウム(Ca)チャンネル
心筋の収縮力は、細胞内のCa濃度によって決定されています。CaチャンネルもNaチャンネルと同じようにCaチャンネルが活性化されて、細胞外のCaを細胞内へ取り込むことで細胞内Ca増加のきっかけとなっています。ある程度の時間開口すると不活性化されてその孔は閉じられます。Naチャンネルとの違いは、Naチャンネルは、細胞が興奮するか興奮しないかを決めているので速いが、Caチャンネルは、細胞内にCaを増加させるというやや時間がかかる仕事を担当しているのでゆっくり開閉しています。
CaチャンネルはL型とT型があります。上記のCaチャンネルはL型で、T型のCaチャンネルは洞房結節の特殊な領域での生理学的意義をもっています。
(3)カリウム(K)チャンネル
心筋細胞が、Naチャンネル(興奮)Caチャンネル(収縮)した後、しっかり元の状態に戻らないと再び興奮する事ができません。つまり細胞内電位を正電位から負の静止膜電位(−90mV)に再度戻さなければなりません。(再分極)Kチャンネルは多種類存在し、安静時膜電位を負に維持する仕事やNaチャンネルやCaチャンネルを介した急速な陽イオンの流入に対して、とりあえず膜電位が正電位になりすぎないように調整したり、ある一定時間興奮したらその後しっかりと負電位に戻す仕事をしています。(電位依存性Kチャネル、内向き整流型Kチャネル)
抗不整脈薬の基本
抗不整脈薬はイオンチャネルの機能を修飾し活動電位波形を変化させて不整脈を抑制します。心臓の各部位で活動電位とそれを支配するイオンチャネルは異なり、洞結節や房室結節ではL型Ca電流に依存した脱分極が、心房や心室の作業心筋ではNa電流に依存した脱分極が活動電位を形成します。活動電位の再分極相は両者ともにK電流に依存します。L型Caチャネル拮抗薬は洞結節や房室結節を抑制し、Naチャネル拮抗薬は心房・心室の脱分極を、Kチャネル拮抗薬は再分極を抑制し抗不整脈作用を発揮します。抗不整脈薬はVaughanWilliams分類によりI群〜IV群に分類されます。I群薬はNaチャネル拮抗薬、II群薬はβ遮断薬、III群薬はKチャネル拮抗薬、IV群薬はCaチャネル拮抗薬です。しかし,多くの薬剤が複数のチャネル抑制作用を併せもっています。Naチャネル拮抗薬は活動電位の立ちあがり速度を減少させ伝導を抑制することにより抗不整脈効果を発揮します。β遮断薬はカテコラミンにより各種イオンチャネルの電気生理学的特性が変化し自動能の充進や不応期の短縮を介して不整脈が起きやすい状態を抑制します。Kチャネル拮抗薬は活動電位幅を広げ不応期を延長させ不整脈を抑制します。IV群薬はCaチャンネル拮抗薬でありCa電流依存性の洞結節や房室結節に作用し不整脈を抑制します。
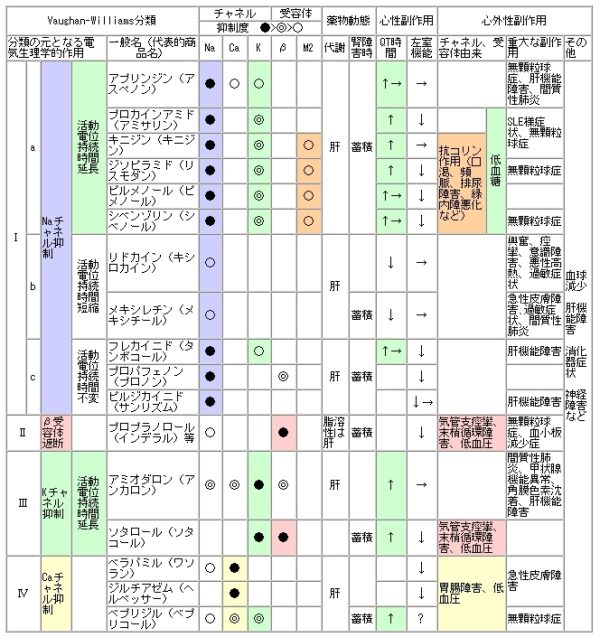
Naチャネル拮抗薬の選択抗不整脈薬は種類が多く選択の幅が広いが、このなかから最適な薬剤を選択するのは不整脈専門医にとっても難しい。しかし、選択すべきではない薬剤をあげることは難しくない。まず,虚血性心疾患や中等度以上の心機能低下例ではNaチャネル拮抗薬の使用は極力ひかえるという原則を押さえておきましょう。
Naチャネル拮抗薬はではピルジカイニド・シベンゾリン・プロバフェノンの3剤と心室性不整脈に使用するメキシレチンを使い分けられるようになれば十分です。Naチャネル拮抗薬の中でどれを選択するかですが、①肝・腎機能障害があるか否か ②不整脈が交感神経緊張型か副交感神経緊張型か ③心収縮抑制作用が強いか否かがポイントです。ビルジカイニドはNaチャネル遮断作用のみを有する腎排泄型の薬剤,シベンゾリンは抗コリン作用を有する肝(20%)腎(80%)排泄型の薬剤,プロパフェノンはβ遮断作用を有する肝排泄型の薬剤なので、肝機能障害のある患者ではピルジカイニドかシベンゾリン,腎機能障害のある患者ではプロパフェノンという選択でも構いません。また、日中の活動時に出現しやすい交感神経緊張型の不整脈で腎機能障害がある場合にはプロパフェノンが適当であり、逆に、夕食後のリラックスした時間に出現しやすい副交感神経緊張型の不整脈で肝機能障害がある場合にはプロパフェノンは不適切と考えます。不整脈が交感神経緊張型なのか副交感神経緊張型なのか判断しにくい場合にはピルジカイニドが無難でしょう。ビルジカイニドは、不整脈の素人に使いやすい抗不整脈薬です。そこそこ効いてより安全です。Vaughan Williams分類ではIc群に分類されていますが、作用機序は単純で、ピュアーなNaチャンネル遮断薬です。代謝も腎臓のみ。副作用は、陰性変力作用ですが弱いです。K電流への影響はないので、QT延長に伴う催不整脈作用がなく、torsades de pointesを生じにくい。一番の適応は、発作性の心房細動です。メキシレチンは心房筋への作用が弱く心室性不整脈に対して使用します。心収縮抑制作用は弱く、洞結節や房室結節にも作用せず、QT延長作用もないので、器質的心疾患による心機能低下例にも使いやすい。
| Ia | シベンゾリン (シベノール) |
錠 100mg 50mg | 内服 1回100mg 1日2〜3回 1日200〜300mgから開始し、450mgまで増量可 |
| Ia | ジゾピラミド (リスモダン) |
カプセル 100mg 注 50mg/ 5ml |
内服 1回100mgを 1日3回 注射 1回 50〜100mg を5分以上かけてゆっくり静注 |
| Ib | メキシレチン (メキシチール) |
カプセル 100mg 注 125mg/5ml |
内服 1回100〜150mg 1日3回 1日300〜450mg 注射 1回125mg(2〜3mg/kg)を5〜10分以上かけて静注又は0.4〜0.6mg/kg/時で点滴 |
| Ic | ピルジカイニド (サンリズム) |
カプセル 50mg | 内服 1回50mg 1日3回 1日150mg 1日225mgまで増量可 |
| Ic | プロパフェノン (プロノン) |
錠 100mg 150mg | 内服 1回 150mg 1日3回 100mg錠は高齢者等への初期投与量 |
| II | ビソプロロール (メインテート) |
錠 2.5mg 5mg | 内服 1回2.5〜5mg 1日1回 1日2.5〜5mg |
| Ⅳ | ベラパミル (ワソラン) |
錠 40mg 注 5mg/2ml |
内服 1回1〜2錠(40〜80mg)を 1日3回 注射 1回5mgを必要に応じて生食又はブドウ糖液で希釈して徐々に静注 |
カテコールアミン誘発性多形性心室頻拍
カテコラミン誘発性多型性心室頻拍(catecholaminergic polymorphic ventricular tachycardia: CPVT)は遺伝性の不整脈疾患で、1978年Coumelらにより4人の小児例が初めて報告されました。運動や情動の変化、あるいはカテコラミン投与で、二方向性あるいは多形性の心室頻拍が誘発され、心室細動に移行して失神、突然死を起こす比較的稀な疾患です。突然死のリスクが高い疾患ですが、有効な薬剤がありますので早期の診断および適切な治療が必要です。
病因
CPVTは常染色体優性遺伝例では1q42-q43 に存在するリアノジン受容体RyR2の遺伝子異常が、常染色体劣性遺伝例では1p11-p13.3に存在するcalsequestrin 2 (CASQ2)遺伝子異常が発見された。これらの異常により、筋小胞体から大量のCa2+放出がおこり、トリガードアクティビティーを機序とする心室頻拍が起こるとされている
症状
約30%の患者さんに失神および突然死の家族歴を認めます。身体的、感情的ストレスを契機に、失神や心停止をきたします。小児期から青年期の間に失神や心停止で発症するものが多く、平均発症年齢は7~10歳と報告されています。時として診断が遅れることがあり、青年以降または中年以降に診断される例もあります。
Leenhardtらは、カテコラミン誘発性心室頻拍21例について18年間にわたる経過観察を行い、本症候群の臨床病像の特徴を挙げています。年齢;9.9±4歳、運動により失神発作が誘発される。基礎疾患はなく、心電図のQT間隔は正常である。失神発作の原因は、多源性心室頻拍、2方向性心室頻拍、多形性心室頻拍などから心室細動に移行することにより起こる。家族歴に失神(33.3%)急死(14.3%)を高率に認める。平均7年間の経過観察中に失神3例(14.3%)、突然死2例(9.5%)を認めた。失神出現年齢は7.8±4歳(3〜16歳)であった。β遮断薬投与により症状、所見の著明な改善を認めた。
住友らは、わが国に於ける多施設協同研究において、本症(CPVT)35例を集め、その臨床病像、予後、治療について検討しています。性別:男性14例、女性21例。発症年齢:平均11±7.3歳で、2〜37歳。合併心疾患:軽症肺動脈狭窄、血管輪各1例を認めたが、何れも軽症例であった。遺伝:31家系中に6家系(19%)に家族歴を認め、何れも常染色体性優性遺伝形式を示した。臨床症状:失神を32例(91%)に認めた。3例では失神を認めず、家族歴から発見された。
原因遺伝子と発生機序
CPVTは遺伝性の疾患で、常染色体性優性遺伝形式をとるものと常染色体性劣性遺伝形式をとるものとがある。原因遺伝子は、1999年、Swanらは、常染色体性遺伝形式を示す2家系を報告し、この家系の遺伝子解析により変異遺伝子座が1q42-q43染色体にあることを報告し、2002年、Priori らは1q42-q43に存在する心臓リアノジン受容体遺伝子(RyR2)の変異がCPVTの発症に関与することを指摘した。リアノジン受容体(RyR)は心筋細胞内の筋小胞体膜にあり、Ca++induced Ca++-releaseを介して細胞内Ca++濃度の調節に重要な役割を演じている。遺伝子検査によるRyR2遺伝子変異の検出率40~60%と報告されています。また、2001年、Lahatらは常染色体性劣性遺伝形式を示すCPVT家系において、CASQ2(calsequestrin 2)遺伝子変異を報告した。calsequestrin 2蛋白は心筋の筋小胞体における主要なCa貯蔵を担っている物質である。これらの遺伝子異常により心筋細胞内の筋小胞体というカルシウムイオンの貯蔵庫からカルシウムイオンが漏れ出て、これに交感神経刺激が加わることによって、細胞内のカルシウムイオンがさらに増加して、トリガードアクティビティーを機序とする心室頻拍が起こるとされています。
診断
患者さんは運動したり興奮したりするときに失神発作を起こすことが多く、これまでの発作の状況を問診します。また血縁者の中にCPVTと診断されている方がいないか、若くして突然死した方がいないかなどを詳しく問診します。安静時の心電図は正常です。運動負荷心電図またはホルタ―心電図では、運動負荷の増加に伴って心室性期外収縮が出現し、やがて特徴的な二方向性心室頻拍に移行します。負荷をさらに続行すると、多形性心室頻拍を経て心室細動に至ることがあります。βアドレナリン受容体刺激薬(イソプロテレノール)の点滴によって運動負荷と同様の不整脈が誘発されます。
【診断基準】
1.器質的心疾患を認めず、心電図が正常な40歳未満の患者で、運動もしくはカテコラミン投与により、他に原因が考えられない二方向性心室頻拍、多形性心室頻拍、多形性心室期外収縮が誘発されるもの。
2.発端者もしくはその家族に、CPVTに関連する遺伝子異常を認めるもの。
3.発端者の家族に、心疾患を認めないにも関わらず、運動により多形性心室期外収縮、二方向性心室頻拍もしくは多形性心室頻拍が誘発されるもの。
4.器質的心疾患、冠動脈疾患を認めず、心電図が正常な40歳以上の患者で、運動もしくはカテコラミン投与により、他に原因が考えられない二方向性心室頻拍、多形性心室期外収縮、多形性心室頻拍が誘発されるもの。
1、2、3は確定、4は疑い
治療
生活指導は、個々の患者さんの状況に応じて運動を制限または禁止します。薬剤は、β遮断薬が第一選択となりますが、β遮断薬単独で効果が得られない場合は、ATPやカルシウム拮抗薬(ベラパミル)ナトリウム遮断薬(フレカイニド:タンボコール)を併用することがあります。心停止を起こしたことのある患者さんや、薬剤によって不整脈が抑制されない患者さんは、植込み型除細動器(ICD)をお勧めする場合があります。未治療では40歳までの死亡率が30~50%と極めて不良であることが報告されているが、早期診断をおこなって薬剤治療を行なっても10年で15から40%死亡すると報告されています。適切な生活指導と薬物治療(場合によってはICD治療を選択するが、頻回作動の危険性も報告されている)を行うことが重要です。星状神経節ブロックの有効性も報告されている。
Wide QRS regular tachycardiaの鑑別疾患として,心室頻拍,脚ブロックまたは変行伝導を伴う上室性頻拍が挙がる。また,同じ患者の非発作時の心電図と比較することも重要である。非発作時のQRS波と一緒か,特にQRS幅がnarrowかwideかを比較する。
本症例は,洞調律の完全右脚ブロック波形で,発作時のQRS波と同様であった。この時点で,脚ブロックを伴う上室性頻拍の診断となる。引き続き,上室性頻拍の鑑別が必要となる。洞頻脈,発作性上室頻拍(PSVT),伝導比が一定の心房粗動(AFL)が鑑別疾患として挙がる。その鑑別のため,QRSに先行するP波の有無,鋸歯状波につき確認する。本症例は,下壁誘導(Ⅱ,Ⅲ,aVF)で下向きの鋸歯状波があるようにも見える一方で,QRSに先行する陰性P波があるようにも見える。その場合,確定診断と治療目的にCa拮抗薬(ベラパミル)を静注するとよい。心房粗動の場合,房室伝導比が低下することで粗動波を観察でき,確定診断に至ることができる。本症例は,当科受診時は洞調律に復していたためベラパミル静注は使用していないが,図3のようにホルター心電図で,伝導比が低下した箇所で下向きの粗動波を確認し,心房粗動の確定診断に至った。
通常型心房粗動は,興奮が三尖弁輪を反時計方向に回転することにより発生する。三尖弁輪を1回転する周期は300/分前後になることが多い。本症例のように2:1で心室に伝導した場合,心拍数はその半分の約150/分になる。よって,上室性頻拍で心拍数が150前後の場合,2:1伝導の心房粗動も鑑別に挙げ鋸歯状波がないか確認することで,診断に近づく。
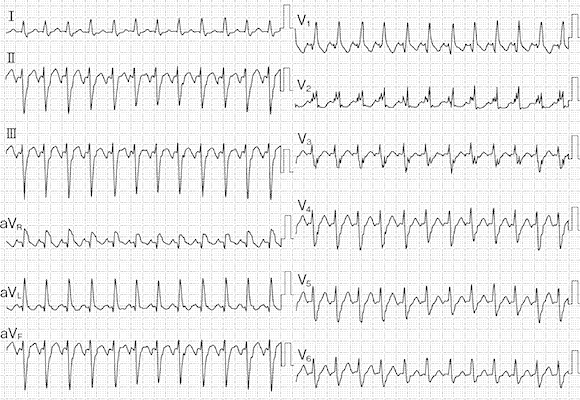
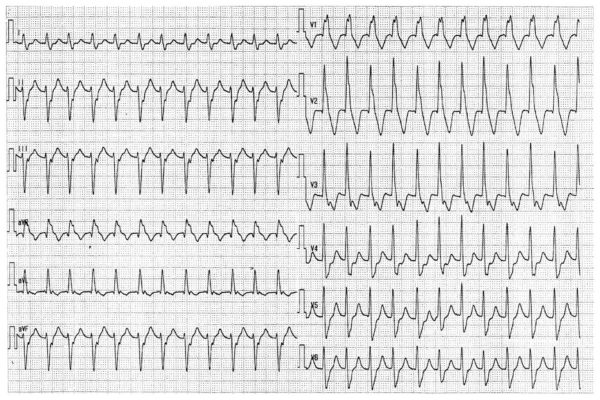

心室頻拍もどきアーチファクト 病棟のナースステーションでのモニター心電図です。ちょっと慌てますよね。一見、心室頻拍ですが、病室へ駆けつけると本人は「何事ですか?」って平気な顔です。それはそれでよかったんですが・・・。なんでこんな心電図になったんでしょうか。実は、患者さんは、歯みがきをしていたんです。筋肉の動きでアーチファクトが出てしまったんです。モニター心電図を貼る場所が悪かったわけです。ちゃんと筋肉の運動を拾わないところに付け替えなければなりません。こんな心電図が、詰め所でしょっちゅう出ていると本当に心室頻拍が出たときにまたアーチファクトかと思ってしまうオオカミ少年になりかねませんよね。