薬剤耐性:AMR (Antimicrobial resistance)とは、薬剤に対して抵抗性を持ち、これらの薬剤が効かない、もしくは効きにくくなる現象のことです。1980年以降、今まで効いていた抗菌薬が効かない薬剤耐性を持つ細菌が世界中で増えてきています。このため、抗菌薬の効かない感染症が増加して感染症の治療が難しくなって重症化しやすくなり、さらには死亡に至る可能性が高くなってしまいます。
国立国際医療研究センター病院と国立感染症研究所の研究グループが、抗生物質(抗菌薬)の効かない薬剤耐性(AMR)をもった菌による被害で、日本でも年間8000人以上が命を落としていると公表しました。(令和元年12月5日)現在、薬剤耐性菌によって米国では年間3万5000人以上、欧州では年間3万3000人以上が死亡していると推計されています。
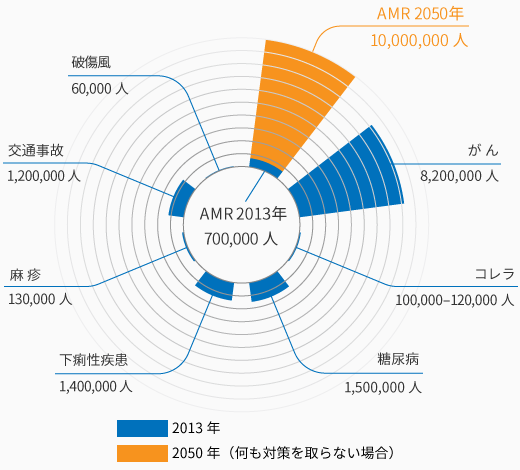
2050年には薬剤耐性菌に関連した死亡数が世界で1000万人以上に達し、がんによる死亡数を越えるる可能性があると言われています。
薬剤耐性化のメカニズム
薬剤耐性菌
我が国においても、メチシリン耐性黄色ブドウ球菌(MRSA)やペニシリン耐性肺炎球菌(PRSP)、基質拡張型ベータラクタマーゼ(ESBL)産生腸内細菌科細菌、多剤耐性緑膿菌(MDRP)、カルバペネム耐性腸内細菌科細菌(CRE)、といった薬剤耐性菌による感染症が広がり大きな問題となっています。
ペニシリン耐性肺炎球菌(PRSP)は、1967年、
基質拡張型ベータラクタマーゼ(ESBL)産生腸内細菌科細菌は、1983年、
多剤耐性緑膿菌(MDRP)、カルバペネム耐性腸内細菌科細菌(CRE)は、2013年
メチシリン耐性黄色ブドウ球菌(MRSA)
黄色ブドウ球菌感染症、特にMRSA感染症は、治療が難しく気の抜けない、死亡率の高い感染症のひとつです。MRSAは院内感染の原因菌として1970年代から問題となっていましたが、現在は市中にも広がっています。幸いなことにMRSAの死亡数は年々減る傾向にあり、病院での抗生物質の適正使用を推進する対策が一定の成果を上げていると見られていますが、市中感染型MRSA感染症は増えているといわれており、市中のMRSAをどうコントロールするかも課題となっています。
ペニシリン耐性肺炎球菌(PRSP)
肺炎球菌はこどもや成人の肺炎や中耳炎、さらには髄膜炎など重症感染症の原因にもなります。小児への結合型肺炎球菌ワクチン定期予防接種の普及により小児の重症肺炎球菌感染症の頻度は激減し、間接効果で成人の肺炎球菌感染症にも減少がみられています。肺炎球菌が他の細菌と異なる点は、感染症により耐性か感受性かの判断が変わる点です。髄膜炎ですと「耐性」と判定する基準が厳しくなり、肺炎だと緩くなります。非髄膜炎の基準を用いると国内にはPRSPはほとんどいませんが、髄膜炎基準だと48%がPRSPです。抗菌薬使用量と耐性率がきれいに相関する細菌であり、抗菌薬適正使用によりさらなる耐性率の減少が期待できます。ワクチンとAMR対策、双方からの対策が必要な細菌です。
基質拡張型ベータラクタマーゼ(ESBL)産生菌
ペニシリン、セフェム、カルバペネムなどのベータラクタム系抗菌薬を分解する酵素はベータラクタマーゼと呼ばれます。この酵素をもつ細菌はその種類によってさまざまな程度で抗菌薬を分解します。ESBLは細菌の名前ではなくべ-タラクタマーゼの一種であり、ペニシリンを分解するベータラクタマーゼである「ペニシリナーゼ」が変異し、より多くの抗菌薬(ペニシリン系、セフェム系)を分解できるようになったものです。ESBL産生菌もMRSA同様、以前は院内感染の原因菌として問題でしたが、現在は市中にも広く定着しつつあります。ESBL産生菌の治療にはカルバペネム系抗菌薬が用いられてきました。抗菌薬投与がESBL獲得の危険因子であることは多くの研究で確認されており、抗菌薬適正使用が大切です。国によっては患者から分離される大腸菌のほとんどがESBL産生菌であり、そのような国では、広域抗菌薬の投与がさらにESBLを生み出すという悪循環に陥ります。
AmpC産生菌
AmpCもESBL同様、ベータラクタマーゼの一種です。AmpCは多くの腸内細菌科細菌がもともと保持していますが、その量が少ない場合にはあまり大きな問題になりません。しかし、この酵素は抗菌薬曝露により誘導されることが知られており、誘導されて過剰に発現するとペニシリン系から第3世代セフェム系まで広範な薬剤耐性を獲得し、臨床上問題となります。EnterobacterやCitrobacterといった菌を治療中、「はじめは感受性があったのに、治療を開始したらあっという間に多剤耐性になった」ということはよくありますが、そのような場合はこのAmpCが原因であることが多いです。AmpCの発現遺伝子は染色体上の場合もプラスミド上の場合もあり、プラスミド上にある場合は、接合による菌同士の耐性遺伝子の受け渡しにより、クレブシエラなど本来AmpCを持たない細菌にも発現することがあります。
多剤耐性緑膿菌(MDRP)
緑膿菌は病原性そのものは弱いため、免疫が正常な人たちには感染症を起こしにくい細菌です。しかし、免疫不全、低栄養などの人たちを中心に、一度感染症を発症すると難治になります。本来、多剤耐性傾向の強い細菌であるため、抗緑膿菌作用のあるペニシリンやセファロスポリン系薬、モノバクタム系、カルバペネム系、フルオロキノロン系、アミノグリコシド系など限られた抗菌薬でしか治療ができません。さらに、耐性機構も多様で新たな薬剤耐性を獲得しやすく、上記の薬剤にも耐性となった緑膿菌が多く存在します。緑膿菌治療のキードラッグであるカルバペネム系、フルオロキノロン系、アミノグリコシド系のすべてに耐性となった緑膿菌をMDRPと呼びます。緑膿菌感染症の治療に使用できる薬剤がもともと少ないこともあり、緑膿菌の薬剤耐性は治療上の大きな問題となります。緑膿菌は環境を通して患者から患者へ広がっていくため、耐性緑膿菌に対しては治療だけでなく、他者へ伝搬させない感染対策も重要です。
カルバペネム耐性腸内細菌科細菌(CRE)
2000年を超えたころより耐性菌治療の切り札であったカルバペネム系薬に耐性の腸内細菌科細菌(大腸菌やクレブシエラ、プロテウスなど、主に腸内でブドウ糖を発酵してエネルギーを得ている細菌)が発見され、次々と世界に広がっていきました。中には現存するすべての抗菌薬に耐性である菌も存在するため、CREの耐性機構には種々ありますが、中でも「カルバペネマーゼ」というあらゆるベータラクタム系薬を分解してしまう酵素をもつ細菌を「カルバペネマーゼ産生腸内細菌科細菌(CPE)」と呼びます。インドで発見されたニューデリーメタロベータラクタマーゼ1(NDM-1)、アメリカでクレブシエラ・ニューモニエから発見されたKPCなどが有名ですが、日本ではIMPというタイプが最もよく検出されています。カルバペネマーゼを産生する遺伝子は一部の細菌を除いてプラスミド上に保持しているので、同種、異種を問わず細菌から細菌へ、まるでソーシャルネットワークのように拡散していきます。日本で過去に数件の病院内アウトブレイク事例があったこともあり、現在、感染症法に基づく届出により感染症例すべてを国に届け出することが義務化され、監視が強化されています。 薬剤耐性菌は病院内で大規模な集団発生をおこすことがあります。病院ではそのようなことがおきないよう対策を行って予防に努めていますが、それでも入院中の患者さんに薬剤耐性菌が広がってしまうことがあるのです。
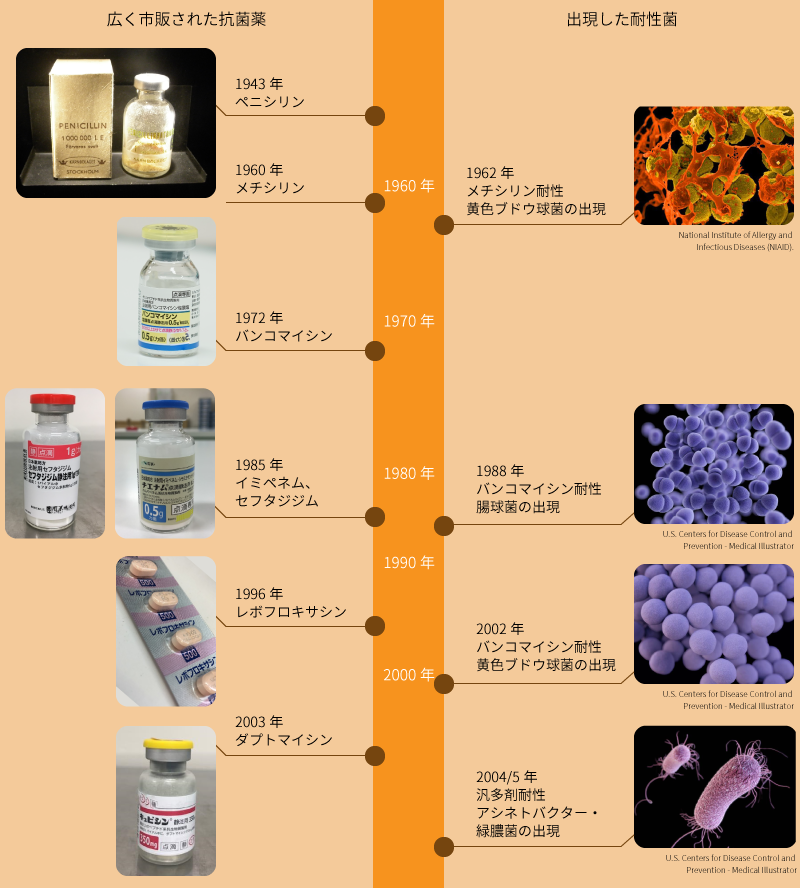
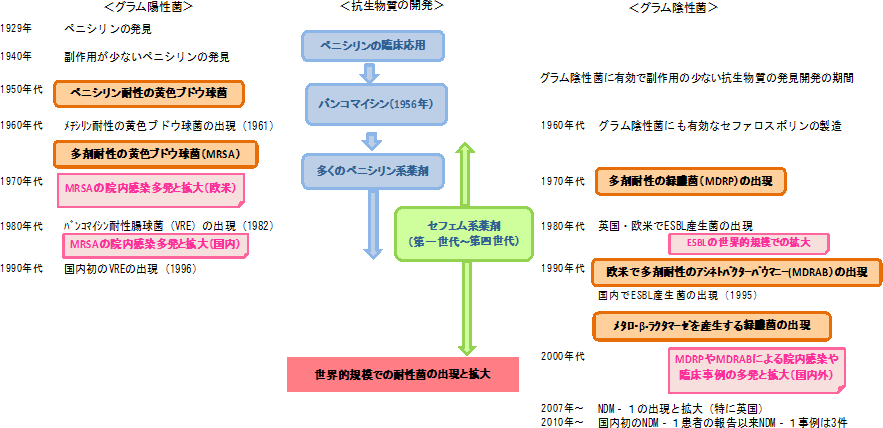
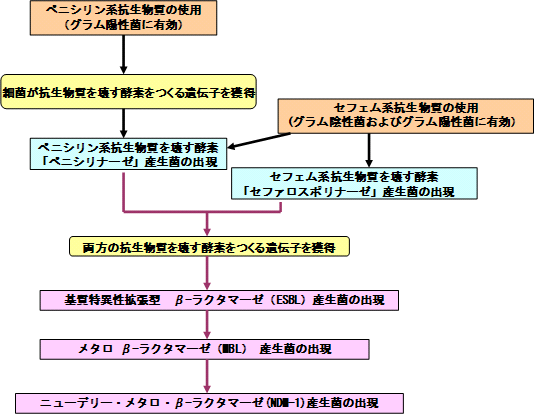
感染症、とくにグラム陽性菌の治療薬にペニシリンの使用を始めた数年後には耐性を示す黄色ブドウ球菌が出現し、これを抑制するためにペニシリン系抗生物質である メチシリンが開発されました。その翌年には、メチシリンに耐性を示す黄色ブドウ球菌が出現しています。
その後、メチシリンだけでなく多くの抗生物質に耐性を示す黄色ブドウ球菌が出現(図2)し、今日に至っています。これをメチシリン耐性黄色ブドウ球菌( methicillin resistant Staphylococcus aureus : MRSA )とよんでいます。
ヨーロッパでは 多剤耐性黄色ブドウ球菌の治療薬として、バンコマイシン(究極の抗生物質とよばれています)が多用され、この結果、イギリスとフランスでバンコマイシンに耐性を示す腸球菌( vancomycin resistant Enterococci : VRE )が検出されました。腸球菌は人間や動物の腸内に存在する 常在菌 のひとつで、ふつうはこの腸球菌が感染症を引き起こす原因となることはありません。多剤耐性黄色ブドウ球菌やバンコマイシン耐性腸球菌は、健康な人に害をおよぼす事はありませんが、重大な基礎疾患がある人や免疫機能が低下した人、あるいは術後感染などで重篤な症状をきたし、敗血症や多臓器不全により死に至ることもあります。
抗生物質による治療は、当初はグラム陽性菌が対象でしたが、その後、グラム陰性菌にも有効なセフェム系などの抗生物質が多数開発されました。ペニシリン系やセフェム系薬剤はβ – ラクタム環をもち、耐性菌がもっているこれらを壊す酵素は総称してβ – ラクタマーゼと呼ばれています。従来ペニシリン系抗生物質だけを壊す酵素と、セフェム 系抗生物質を壊す 酵素がありましたが、両方の抗生物質を壊す、より強力な基質特異性拡張型 β – ラクタマー ゼ( ESBL )という酵素を作るようになったのです(図3)。国内でも、基質特異性拡張型 β – ラクタマーゼを産生する肺炎桿菌、大腸菌やその他の腸内細菌が出現しています。
さらに、もっとも強力なβ – ラクタマーゼといわれているメタロβ – ラクタマーゼ( MBL )が緑膿菌で初めて発見されました。メタロβ – ラクタマーゼはβ – ラクタム環の中心に亜鉛イオンを含む構造で、β – ラクタム環をもつ ほとんどの抗生物質を分解してしまう酵素です。
最近では ニューデリー・メタロ・β – ラクタマーゼ( NDM- 1 )が話題になっています。 2007 年以降、インド、パキスタン等で医療行為を受けて重篤な症状に陥る例が欧米で問題になり、 2010 年には国内でも検出され大きな問題となっています。また、複雑な耐性機構をもち、ほとんどの抗生物質が効かない多剤耐性アシネトバクターによる院内感染も報告されています。
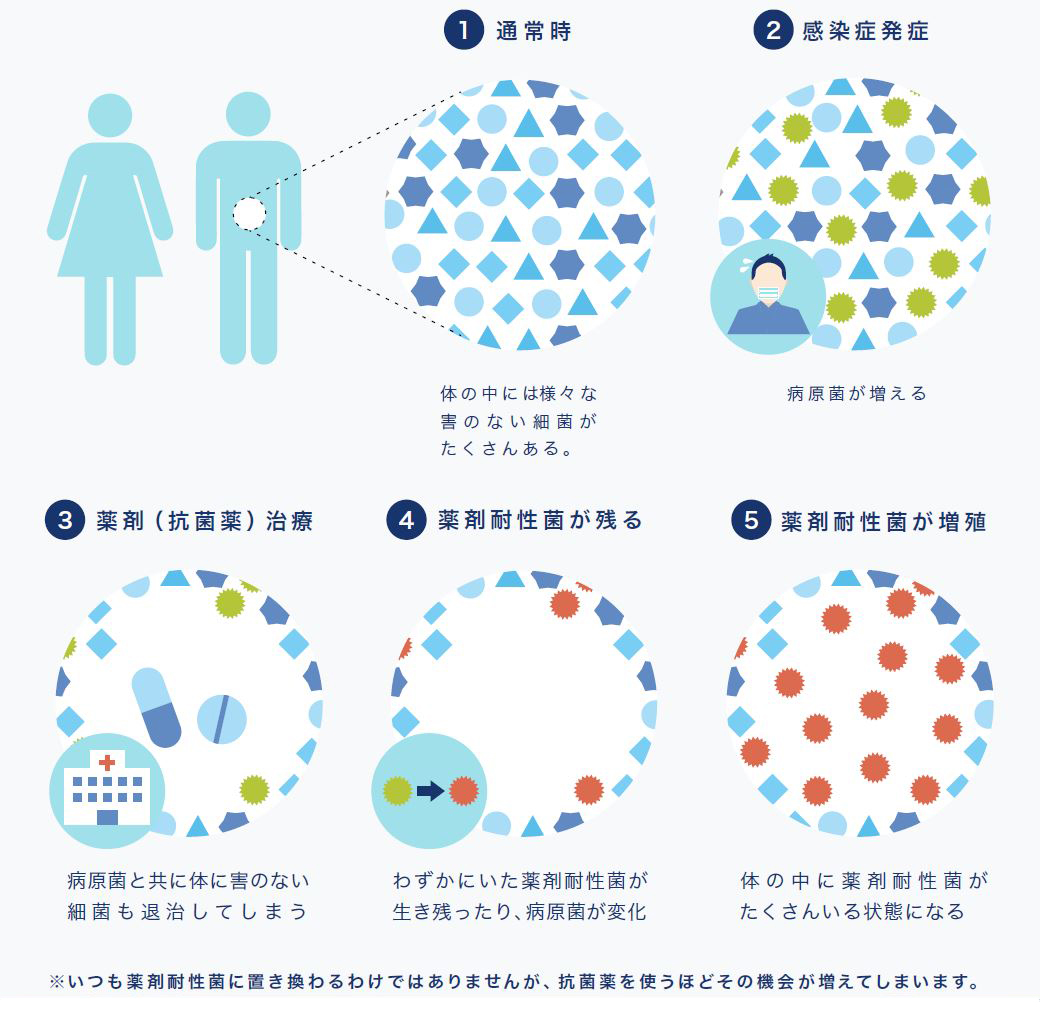
なぜ、抗生物質では殺せない細菌が増え、多くの人の命を奪うようになったのでしょうか。それは、必要以上に抗生物質が使われてきたからです。抗生物質を使うと細菌は大量に死にますが、一部にその成分が細胞質内に入るのを防いだり、無毒化したりする能力を獲得した細菌が現れます。抗生物質をめったやたらに使うと、抗生物質に弱い菌は死に絶えますが、強い菌だけが生き残り、耐性菌ばかりが増えてしまうのです。
なぜ抗生物質の乱用が続いてきたのでしょうか。それは、本来は必要ないにもかかわらず、「念のため」という理由で処方されることが多かったからです。
薬剤耐性菌は世界的な問題となっており、2050年には薬剤耐性菌による死者が年間1000万人に達すると推計されている。日本でも2016年に、政府主導で「薬剤耐性(AMR)対策アクションプラン」が策定され、2020年までに抗菌薬使用量33%減が目標に据えられた。6月1日には、抗菌薬適正使用の指針である「抗微生物薬適正使用の手引き」が厚生労働省から発行されたが、この手引きをどう読み解き、日常臨床でどう活用すればよいのか。「微生物薬適正使用(AMS)等に関する作業部会委員」の座長として手引き作成の中心を担った、国立国際医療研究センター病院副院長の大曲貴夫氏に聞いた。(取材・まとめ:m3.com編集部・小島領平)
――日本の抗菌薬使用状況はどうなっているのでしょうか。
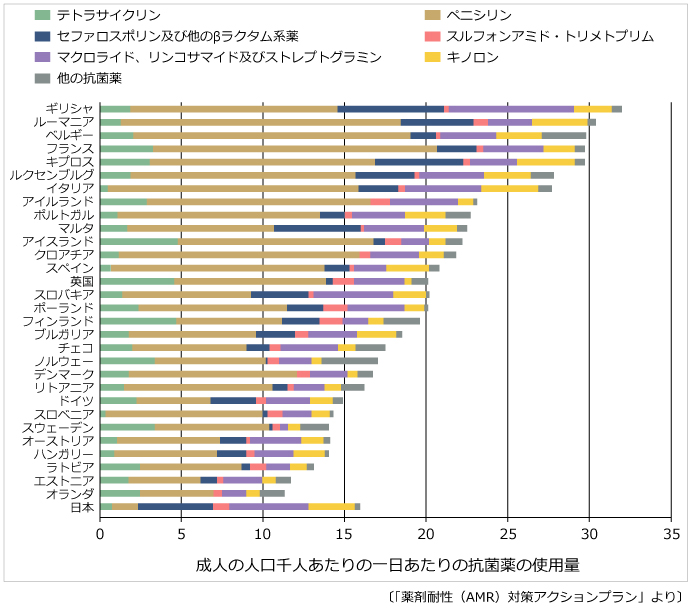
「薬剤耐性(AMR)対策アクションプラン」にも掲載されているデータを見ると、日本の抗菌薬使用量は人口1000人当たり1日約15.8で、欧州諸国との比較でも下から3分の1くらいにとどまっています。ところが内容に目を向けると、セファロスポリン(セフェム系)やキノロン系、マクロライド系など、広域の抗菌薬の使用割合が非常に高い(図)。さらに、経口薬が多いことも特徴です。
――「広域の経口抗菌薬の使用割合が高い」とは何を示しているのでしょうか。
経口薬が多いというのは、外来診療での処方が多いことを示しています。そして、外来診療では、急性気道感染症や下痢症などに抗菌薬を処方することが多い。つまり、決して全てのケースに処方する必要のない疾患に、人類の切り札とも言える広域の抗菌薬を他国よりも多く処方していることになります。
――広域の抗菌薬を処方することの問題点は?
抗菌薬は本来、どの臓器にどのような微生物が問題を起こしているかを把握し、それに効く種類を処方するものです。もちろん、効果が最も高いものを処方することが大切ですが、同じような効果が得られるのならば、いろいろな微生物を治療するような広域抗菌薬よりも、ターゲットの微生物だけを治療する狭域抗菌薬の方が、体の中にいる他の微生物に対する影響が少ないとされています。また、それが耐性菌を出にくくすることにつながるのです。
――耐性菌の出現は仕方のないことなのでしょうか。
抗菌薬を使っていく上で、ある程度は仕方のないことだと言えます。したがって、それをいかに遅らせるか、耐性度を軽くするか、ということが重要になります。
――「抗微生物薬適正使用の手引き」を作成した目的は何でしょうか。
このように、急性気道感染症や下痢症などで、本来は大部分で抗菌薬が不要な場面で実際には処方されてしまっているという問題があります。また、本当は抗菌薬が必要なケースが実はきちんと判別されずにいるという状況もあります。そこを正し、抗菌薬処方の状況を良くしていくために作成しました。
私たちはこれまで、新しい耐性菌が出てきても、さらに新しい抗菌薬を開発することで克服してきました。しかし、新しい抗菌薬が開発されにくくなり、耐性菌の問題が大きくなってくると、その“今まで通り”の方法では解決できなくなってきています。新薬の開発はとても重要で、それを推進することにはもちろん賛成です。しかし、“今まで通り”では、せっかく開発した新薬にもすぐに耐性菌が出現してしまいます。新薬の開発と耐性菌の出現の繰り返し――。この連鎖を断ち切るためには、感染症の診療を変えていかなければならないでしょう。
診療が変われば、開発された新薬の耐性菌が出現するまでの期間を長くすることができます。医療者も患者も、新しい感染症への対応の仕方、抗菌薬との付き合い方をきちんと理解することが根本的な対策につながると思います。こうした正しい感染症診療を呼びかけることも、手引きを作成した目的の一つです。
病院側が謝罪会見を開いていますが、多剤耐性菌がみつかったことでなにか病院が悪いことをしたように受け取られがちですが、多剤耐性菌自体は、日本全国ちまたに広がってしまっているわけで、病院の外から入ってくること自体は目にみえない微生物を排除することは物理的に困難なわけです。MRSAなんて免疫力の落ちた患者さんなら50%は保菌しているわけで、届け出が必要な耐性菌の管理、つまりその病院で診なくてはならない患者背景において、マンパワー、院内感染対策がきちんとできているかどうかが謝るか謝らないかの線引きになるわけです。
風邪に抗生物質は効かないが……
よく言われているのが「風邪」に対してです。かなり知られるようになってきましたが、風邪に抗生物質は効きません。風邪は細菌ではなくウイルスによる感染症なので、抗生物質では治せないのです。しかし、風邪をこじらせて細菌による感染症を起こしては大変と、念のための抗生物質がしばしば処方されてきました。
さらには、患者側の問題も指摘されています。熱や咳で受診した患者に対して、「医師が抗生物質は不要」と診断したとしても、「抗生物質を処方してほしい」と求める患者が少なくないというのです。念のために処方しようとする医師と、薬の販売量を増やそうとする製薬会社、そして自然に治ることの多い風邪のような病気でも抗生物質を欲しがる患者。これら三者の要因が相まって、抗生物質の乱用が蔓延ってきたのです。
抗生物質を乱用すべきでないという感染症専門医などによる指摘は、ずいぶん前(たぶん20年以上前)からありました。しかし、相変わらず風邪に抗生物質を処方するようなことが、ずっと放置されてきたのです。最近になって、ようやく厚労省も重い腰を上げ、医師向けの「抗微生物薬適正使用の手引き」が作成されるなど、薬剤耐性菌対策が行われてきました。そうした取り組みのおかげもあって、風邪に抗生物質を処方する医師はだいぶ減ったと言われています。
とはいえ、まだ無用な抗生物質の処方は残っているようです。同じ国立国際医療研究センターの研究グループが、11月26日にもプレスリリースを出しています。それによると、2012年から2017年の間の外来患者の社会保険データを解析したところ、一般的な風邪症状(せき、鼻水、のどの痛み)を示す「急性気道感染症」の30%以上に抗生物質が処方されていたそうです。
急性気道感染症の相当数は抗生物質が不要と考えられています。09年には約60%と推計されていたので半減したとはいえ、まだかなりの量の抗生物質が処方されていると思われます。しかも、処方割合は抵抗力の弱い乳幼児や高齢者よりも、抵抗力の強い人が多いはずの10代から40代のほうが高かったそうです。こうしたデータから見ても、まだまだ抗生物質の適正使用対策を推し進める必要のあることがわかります。
薬剤耐性菌の蔓延は、世界中に深刻な問題を引き起こすと懸念されています。なぜなら、ペニシリンから始まる抗生物質の登場によって治るようになったはずの感染症が、再び治せなくなってしまい、抵抗力の弱いお年寄りや新生児、重い病気の人などが多く入院する病院などで感染の爆発的拡大──アウトブレイク──を頻発させる恐れがあるからです。
こうした深刻な事態を招かないためにも、医師側だけでなく患者側のほうも、「抗生物質は必要なケースに絞って大切に使う」という意識に変えていくべきです。
ところが、この11月、東京大学医科学研究所の研究グループが、ゾフルーザを投与された38人を対象に調べたところ、9人に耐性ウイルスが検出されたと発表しました。とくに15歳以下の小児で頻度が高く、約3割が耐性化していたそうです。この耐性ウイルスが蔓延するかどうかは今のところわかりませんし、すぐに問題にはならないかもしれません。
ですが、問題は新型インフルエンザなどの爆発的流行(パンデミック)が起こった場合です。実は、これに備えて国家備蓄されているタミフルでも、すでに耐性ウイルスが見つかっています。もし、いざというときに「効く薬がない」となると、せっかくの備蓄が無駄になってしまいます。そして、パンデミックが起こった時には、まっさきに抵抗力の弱いお年寄りや乳幼児、重病人などが犠牲となるでしょう。
抵抗力のある健康な人であれば、風邪やインフルエンザのほとんどは自然に治ります。もちろん、重症化することもあるので侮ってはいけませんが、今のように抗生物質や抗インフルエンザ薬をむやみやたらに使っていると、薬が効かない細菌やウイルスがどんどん増えてしまって、将来、人類全体が後悔することにもなりかねないのです。
日本人は「薬をもらうために医師にかかる」という意識を持っている人が多く、風邪やインフルエンザで薬を処方してもらえないと、「ケチな医者だ」と思う人も中にはいることでしょう。しかし、その人に薬が必要かどうかを見極め、ときには「薬は不要です」と言える人こそが、良心的で優秀な医師なのです。今回の薬剤耐性菌のニュースをきっかけに、日本人の「薬」に対する意識が変わることを期待したいと思います。
多くの場合、医学・病理学、生物学の分野では、細菌やウイルスに対して薬剤が効かない、または効きにくくなることを指し、農学の分野では殺虫剤に対する病害虫の耐性や、除草剤に対する植物の耐性を指します。ここでは生物学の視点から、薬剤耐性菌について詳しく説明します。
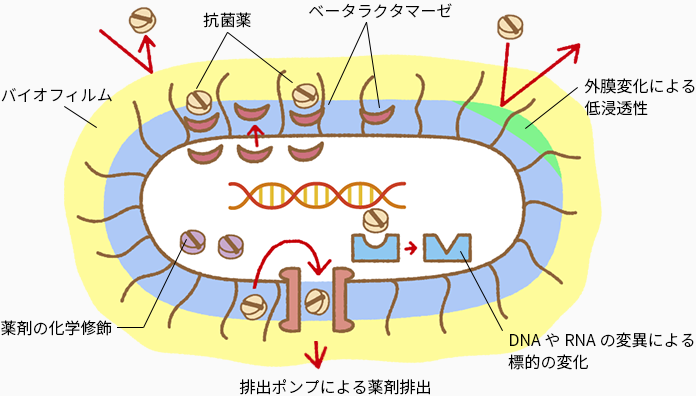
【薬剤耐性菌発生のメカニズム】
(1)薬剤の不活性化
細菌自身が薬剤を化学的に修飾、分解する酵素を作り出すことで、細菌が耐性を獲得します。この耐性獲得法は最もよく見られる耐性機構です。
(2)薬剤作用点の変化
薬は「鍵と鍵穴の関係」とよく言われるように、細菌の特定の部位に特異的に作用するようになっています。そのため、薬剤が作用していた細菌の部位の構造が変化すると薬剤の効果は得られなくなります。このような薬剤耐性獲得機構はウイルスでよく確認されます。

(3)薬剤を排出するポンプを獲得する
3つめの薬剤耐性機構として、薬剤を排出するポンプを獲得することが挙げられます。1つの薬のみを外へ排出するポンプであれば他の薬剤を使う事で目的の細菌を殺すことができますが、1つのポンプが何種類もの薬剤を排出する機能をもつことがあります。このポンプを獲得した場合、一度に多くの薬剤に対する体制を獲得してしまうため大きな問題となります。
【薬剤耐性菌が発生しやすい条件】
(1)薬剤の低濃度投与
薬の濃度が低いため細菌が完全には死滅せず、その結果菌が薬剤に徐々に慣れてしまい、耐性を獲得しやすい環境となってしまいます。
(2)薬剤投与の中断
感染症などの治療で薬剤を使用していたにもかかわらず完治前に投与をやめてしまうと、耐性菌のみが生き残った状態で感染症をぶり返し、さらに悪化させてしまう可能性があります。
(3)同じ薬剤の長期投与
同じ薬剤を長い時間投与するほど細菌が薬剤に慣れ、耐性菌の発生確率が高まります。
このように、耐性菌の出現を抑えるためには、上記のような条件を避けて薬剤を使用する必要があります。
アクションプラン 3本の柱 サーベイランス 適正使用
セファロスポリン マクロライド キノロンが好きな国
抗菌薬の9割は経口薬 1割注射 7割が市中外来投与 2割は病院
外来の耐性菌はペニシリン耐性肺炎球菌 マクロライド耐性マイコプラズマ
抗菌薬投与理由 重症かなどにエビデンスない 2位が患者希望