原発性アルドステロン症
高血圧症は、厚労省の集計では全国で約4000万人の患者様が推定されている日本で最多の病気、すなわち「国民病」です。高血圧の多くはその原因が特定できない本態性高血圧ですが、約10%は原因が特定できる二次性高血圧と言われています。その中でも、特定のホルモンが過剰になることで血圧が上昇する内分泌性高血圧の代表格が、原発性アルドステロン症です。原発性アルドステロン症は、1956年に米国のコーン先生が第一例目を報告されて(1956年、鳥飼龍生先生が本邦における第1例を報告)当初は、高血圧の1/3を占める低レニン性の高血圧は全て原発性アルドステロン症ではないかという仮説のもと大変注目されて研究されたわけですが、アルドステロン過剰により生じる低カリウム血症を呈する症例を目安に診断を行っていたので、典型的な症例は高血圧の1.0%にも満たないとされ、疾患としては重要だが高血圧全体の中では非常にまれな疾患でそれほど気にすることはないという扱いになっていました。しかし、最近の研究でアルドステロンが単にナトリウムとカリウムを調節して血圧のコントロールをしているだけでなく、アルドステロン自体が心血管系で局所産生され、直接心筋や血管などに作用して直接臓器障害を示すことが報告され再度、脚光を浴びることになりました。本来、原発性アルドステロン症というのは低レニンの疾患で、高レニンの疾患に比べれば臓器障害が少ないというのが高血圧の常識的な考え方でしたが、実際は原発性アルドステロン症の約半分の症例で脳梗塞、心血管障害、腎障害などかなりの合併症が起こることがわかってきました。また、近年では、高血圧患者全体を対象としてスクリーニング検査を行うことが推奨されるようになり、高血圧患者に占める原発性アルドステロン症の割合が増加しています。原発性アルドステロン症では副腎から過剰に分泌されるアルドステロンにより,低カリウム血症が生じる以前の段階から, レニン・アンジオテンシン系に負のフィードバックがかかりレニン活性が低下するため, アルドステロンをレニン活性で割った ARR が増加します。(1981年信州大学の平松先生が発表) 1994 年にオーストラリアの Gordon 先生が,高血圧専門施設で 199 例の血清カリウム正常の高血圧患者を ARR を用いて,スクリーニングし, 約10%が原発性アルドステロン症であろうと報告しました。この論文がきっかけとなり ARR を原発性アルドステロン症のスクリーニングに用いた研究調査が多くの施設で行われ, 高血圧の 3~20%が原発性アルドステロン症ではないかと考えられるようになりました。我が国の報告では、横浜労災の西川先生の報告では6%(大病院の内分泌科を受診)京都医療センターの成瀬先生の報告(PHAS-J)では3.3%(144の市中病院の一般診療科を受診した高血圧)大学病院など専門施設や治療抵抗性高血圧(治療抵抗性の中では20%)を対象にした場合などではやや高めに評価している可能性があり,中小の病院や診療所とは背景での高血圧をスクリーニングすれば、原発性アルドステロン症の頻度は 5%ぐらいが妥当な線ではないかと思います。高血圧の5%(全国で200万人)を占めるとされています。5%というと僕たちが日頃診ている患者さんの中に相当数の2次性高血圧症が含まれているわけで、未だに多くの患者様が適切な診断や治療を受けられていないのが現状です。1998 年の厚生省の班会議の調査では,原発性アルドステロン症の全国推定患者数を 1,450 例と報告しています。 約 700 例に 1 例しか診断されていないのかもしれません。

原発性アルドステロン症は、アルドステロンというホルモンが過剰に分泌されることで高血圧が引き起こされる病気です。腎臓の上部に乗っかるような形で、副腎という小さな臓器が左右一個ずつあります。アルドステロンは、副腎から分泌されるホルモンで、体内の塩分(ナトリウム)や水分の量を調整して、血圧を正常に維持する働きがあります。つまり、健康な状態では、体内の塩分・水分量の低下を受けて腎臓から出されるレニンという酵素によって、アルドステロンの分泌は制御されています。しかし、原発性アルドステロン症では、アルドステロンが自律的に(レニンの分泌と関係なく)過剰に分泌されることで、高血圧や血液中のカリウム濃度の低下低下に伴って、多尿、筋力低下、不整脈などを引き起こします。原発性アルドステロン症には大きく分けて2つのタイプがあります。1つは、副腎腫瘍が原因となるタイプでほとんどが片惻性の良性腫瘍(高齢男性に多い)、もう1つは過形成と呼ばれ、左右両側の副腎全体からアルドステロンが過剰分泌されるタイプです。これらのタイプ別の診断には、副腎静脈サンプリング検査が必須です。

症状
症状としては、普通の高血圧と同様に無症状なことが多く、外から見てもほぼ鑑別は困難ですから、高血圧の患者さん全員を対象にスクリーニングをすることが理想ですが、実臨床の現場で保険診療の範囲で行うとすると、コストとベネフィットの関係でどこかで折り合いをつけなければなりません。原発性アルドステロン症らしき症例を絞って検査するのが現実的です。
発見のポイントは以下になります。
●低カリウム血症がみられる
●30~50歳代(比較的若年者)で高血圧症を患っている
●収縮期血圧が160mmHg以上あるいは拡張期血圧が100mmHg以上の方
●高血圧の家族歴がない
●CT検査で副腎腫瘍が指摘された
●3種類以上の降圧薬でも血圧管理が不十分(治療抵抗高血圧症)
●40歳以下で脳卒中、心筋梗塞を発症した
●睡眠時無呼吸を指摘された
原発性アルドステロン症のうち、低カリウム血症を呈する頻度は20%程度であるとされています。低カリウム血症の症状としては、脱力感、疲労感、筋力低下、四肢麻痺、知覚障害、多尿、多飲、めまい、動悸、不整脈、頭痛などがあります。低カリウム血症というと正常値は3.6〜4.8mEq/Lですが、4を切っていればちょっと低いかなという印象です。また利尿剤を使うと低カリウム血症をきたしやすいのですが、簡単に低カリウム血症を起こすこと自体が原発性アルドステロン症を疑います。II度以上(中等症以上)の高血圧もスクリーニング対象になります。
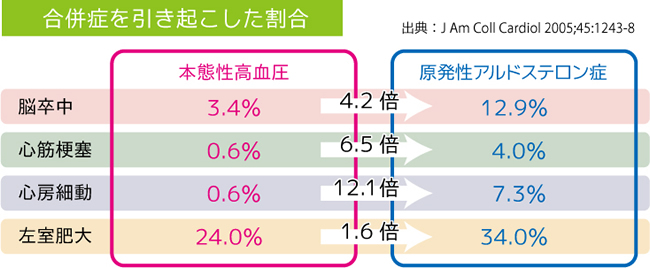
以上、なぜアルドステロン症の診断が大事かというと、まず第一に腫瘍を見つけてこれをとれば治癒可能であること(かなりドラマティックに治る病気であるということ)次に従来考えられていたよりもかなり頻度が高いといういこと、3つ目に若年から治療抵抗性のものが多いということ(かなりの量のお薬を一生飲まなければならない)最後に過剰なアルドステロンそのものが、血管や臓器にダメージを与えるため、本態性高血圧患者に比べて、脳卒中や心房細動、左心室肥大など心血管系の合併症を高率に発症することも報告されています。原発性アルドステロン症は本態性高血圧とは治療内容が異なります。副腎からアルドステロンが過剰に分泌されることで、血圧が上昇する原発性アルドステロン症では、アルドステロンを正常にすることで血圧が改善すると考えられます。このようなアルドステロン過剰に対する治療を行わずに一般の高血圧として治療した場合、これらの合併症のリスクが上昇するという点であり、そのため、高血圧患者の中からこの病気を早期に診断し、適切に治療することが求められます。最近、アルダクトン以外にもセララやミネブロなど選択性の高い抗アルドステロン薬が開発されています。
診断
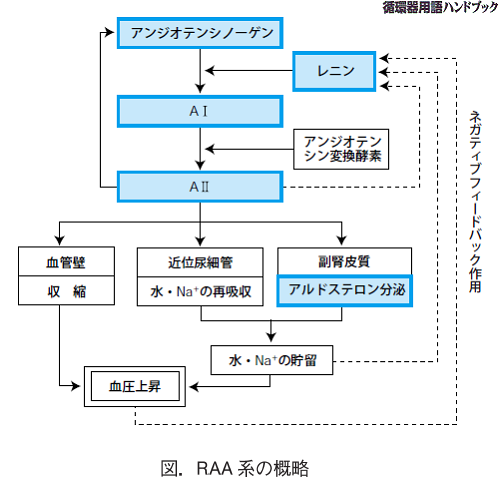
レニン-アンジオテンシン-アルドステロン(RAA)系は、血圧や体液量、血清電解質の調節に関わる、内分泌系の調節機構の1つである。アルドステロン分泌は レニン-アンジオテンシン系によって調節されている。タンパク質分解酵素であるレニンは腎臓の傍糸球体細胞に貯えられている。腎輸入細動脈における血液量と血流量が減少すると腎臓の傍糸球体細胞からレニンが分泌される。レニンは肝臓由来のアンジオテンシノーゲンをアンジオテンシンIに変換し,アンジオテンシンIはアンジオテンシン変換酵素(ACE)によってアンジオテンシンIIに変換される。アンジオテンシンⅡは、その特異的受容体を介して血管平滑筋を収縮させ、強い昇圧作用を示す一方、副腎皮質球状層に作用して、アルドステロンの分泌を促進する。アルドステロンは,副腎で産生される最も強力なミネラルコルチコイドの1つで、アルドステロンの生理作用は、腎臓の遠位尿細管などに作用し、Na再吸収が亢進してNaを体内に貯留することで循環血液量を増加しレニン分泌は抑制される。これがネガティブフィードバック機構である。高血圧の約90%は原因が特定できない本態性高血圧ですが、その場合は塩分(ナトリウム)を過剰に摂取するとレニンの分泌が抑制されるため、アルドステロンも低い値を示します。しかし、原発性アルドステロン症では、塩分摂取が過剰であっても副腎からアルドステロンが過剰に分泌されます。ここが原発性アルドステロン症と本態性高血圧の違いになります。
原発性アルドステロン症の診断手順を示します。
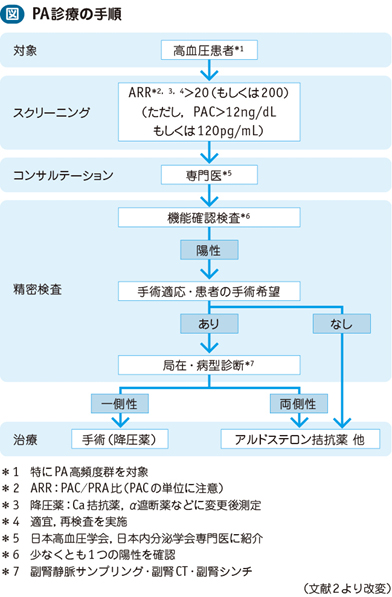
(Step1)血液検査
クッシング症候群や先端肥大症などは臨床的な特徴ありますが、原発性アルドステロン症は、普通の高血圧と同様に外見からは見分けがつきません。まずはスクリーニング検査として血液検査を行います。アルドステロンの分泌過剰を確かめるため、血液中のアルドステロン濃度を測定します。また、アルドステロンは、腎臓から分泌されるレニンという酵素により調節されているため、血漿レニン活性が抑制されていることを確認する必要もあり、血中のレニン活性も同時に測定します。原発性アルドステロン症では、アルドステロン濃度が高くなり、レニン活性が低下しますので、両者の比率(アルドステロン・レニン比:ARR)が増加します。計算により求めたARRが200以上の場合には、原発性アルドステロン症の疑いがあります。典型例は全く問題なく、アルドステロン濃度250 (pg/mL)も高いし、レニン活性0.2 (ng/mL/hr) も抑制されている場合は、ARR=250/0.2=1250(ARR比>1000のものなどが確実)となり、ARRが200以上なので原発性アルドステロン症の疑いになります。しかし、実際は、判断が悩ましい際どい場合も多く、また、アルドステロン値は変動が激しいので、1回だけの測定で正常でもアルドステロン症は否定はできません。疑わしければ、再度、検査をする必要があります。また、単位がng/dlとpg/mlになっているので注意(検査機関によって単位が違う)が必要です。、PAC(血中アルドステロン濃度:pg/ml)/PRA(血漿レニン活性:ng/ml/hr)比>200 (費用は5400円かかります)
![]()
教科書的には、レニン活性やアルドステロン濃度は日内変動があり、姿勢によっても大きく変動しますので、理想を言えば午前中の早い時間帯に約30分間安静にして仰臥位で採血します。また、ARRは高血圧患者が服用している降圧薬の種類に影響されることが知られています。降圧薬として利尿薬は6週間以上、β遮断薬は2週間以上は休薬もしくは他の降圧薬(血管拡張薬のブドララジン、α遮断薬やカルシウム拮抗薬)に変更し、ARR検査を行うべきであるなどと書かれていますが、大学ではいざ知らず、実臨床でそんなことはやってられません。ただ、アルダクトン(ミネラルコルチコイド受容体拮抗薬)だけは影響が強いので、飲んでしまうと原発性アルドステロン症かどうかは訳がわからなくなってしまいます。検査前には4週間は休薬してと書いてありますが、実際はアルダクトンの影響は1年以上続くので検査前に飲んでしまうと検査は困難です。実臨床では、Ca拮抗薬、αブロッカー(ARB、ACEもほぼ大丈夫)は、診断上、影響が少ないので、そのまま服用したままでARRを測定しても結構です。

低レニン性高血圧
原発性アルドステロン症(primary aldosteronism:PA)は当然低レニン性高血圧症になりますが、わが国では塩分感受性の本態性高血圧が多く,これらの症例の多くは低レニンを示します。原発性アルドステロン症のスクリーニングはaldosterone/renin ratio:ARR>が200の場合とされています。しかし、PRAが0.1未満の症例は、アルドステロン値が30pg/mlでもARRは30/0.1=300で200以上となり原発性アルドステロン症という診断になってしまいます。そこでPACの絶対値>120~150pg/mLも考慮するよう示されていますが,PACの絶対値>120~150pg/mLのみの症例を対象とすると,軽症のPAを見逃す可能性があります。実際,PAC<100pg/mLである軽症のPAも存在するので,PAを完全には否定できません。糖尿病や慢性腎臓病、甘草摂取が原因となる偽性アルドステロン症も,低レニン性低アルドステロン血症を示します。甘草は,健康食品や漢方薬に多く使用されるため,摂取が見逃されることも少なくありません。また,PACは日内変動により午後に低値になるため,測定時間も考慮が必要です。高齢者や高塩分食などでPRAは低値となります。(極度の脱水、減塩時にはPRA高値になる)β遮断薬,交感神経抑制薬,NSAIDsなどの薬剤の影響でも,PRAは低値を示すことがあります。以上,本例のようにPRAの抑制が強く,PACが高値でないにもかかわらずARR>200となる病態や環境は,日常臨床においては,PAでなくても多く経験することになります。初回採血のみでARR>200を評価することは困難な場合が多く,年齢,既往歴,食生活,投薬歴,測定条件を再検討して,ARR再検を行うことが重要になります。
血液検査でARRが200以上の場合は、原発性アルドステロン症の疑いがあります。この場合は専門医療機関で検査を行い、原発性アルドステロン症かどうか確定診断を行います。確定診断のために負荷試験を実施します。負荷試験とは薬剤を投与したときのホルモンの反応を見る検査で、通常、①カプトプリル負荷試験、②フロセミド立位負荷試験、③生理食塩水負荷試験の3つの試験のうち2つ以上の試験が行われます。少なくとも一つ以上の検査が陽性であることが必要です。スクリーニング検査で原発性アルドステロン症が疑われ負荷試験を施行された患者のうち、約30%程度が確定診断に至ります。

負荷試験が1つ以上陽性の場合は、原発性アルドステロン症と診断して、次のステップへ進みます。
(Step3)局在診断
原発性アルドステロン症は,副腎皮質の自律的なアルドステロン産生(過形成、腺腫、または癌腫による)により引き起こされるアルドステロン症である。原発性アルドステロン症と確定診断された場合は、外科手術または薬物療法を行います。外科手術を希望されない場合は、これ以上の検査は必要ありません。抗アルドステロン薬を投与し、必要に応じてCa拮抗薬などの各種降圧薬を組み合わせて治療を行います。外科手術を希望される場合、局在診断を行うためには、腹部CTの1〜5mmスライスが最も感度が良いとされています。MRIは解像度が悪く、シンチも感度は低く、陽性に出たらいいが出なくても否定できません。典型的な症例では、副腎に直径1〜2cmの腫瘍が見つかりますが(腫瘤が8mm以上の場合は90%は病変が一致)その腫瘍からアルドステロンが出ているとは限りません。また、原発性アルドステロン症の腫瘍はしばしば小さく、約半数程度の腫瘍はCTでは見つからないことも珍しくありませんし、多発性であったり、腫瘍(非機能性)と反対側あるいは両側に病変が存在する場合もあり、画像検査だけでは治療方針の決定はできません。最近、原発性アルドステロン症にはCT陰性の「アルドステロン産生微小腺腫」が多数存在することが分かってきました。これは直径数mm程度の小さな腫瘍で、副腎静脈サンプリングというカテーテル検査でしか診断できません。PAによる高血圧はアルドステロン産生腺腫の大きさとは関係ないため、このような微少腺腫でも重症な高血圧を引き起こします。つまり、CT検査には限界があることには注意が必要です。
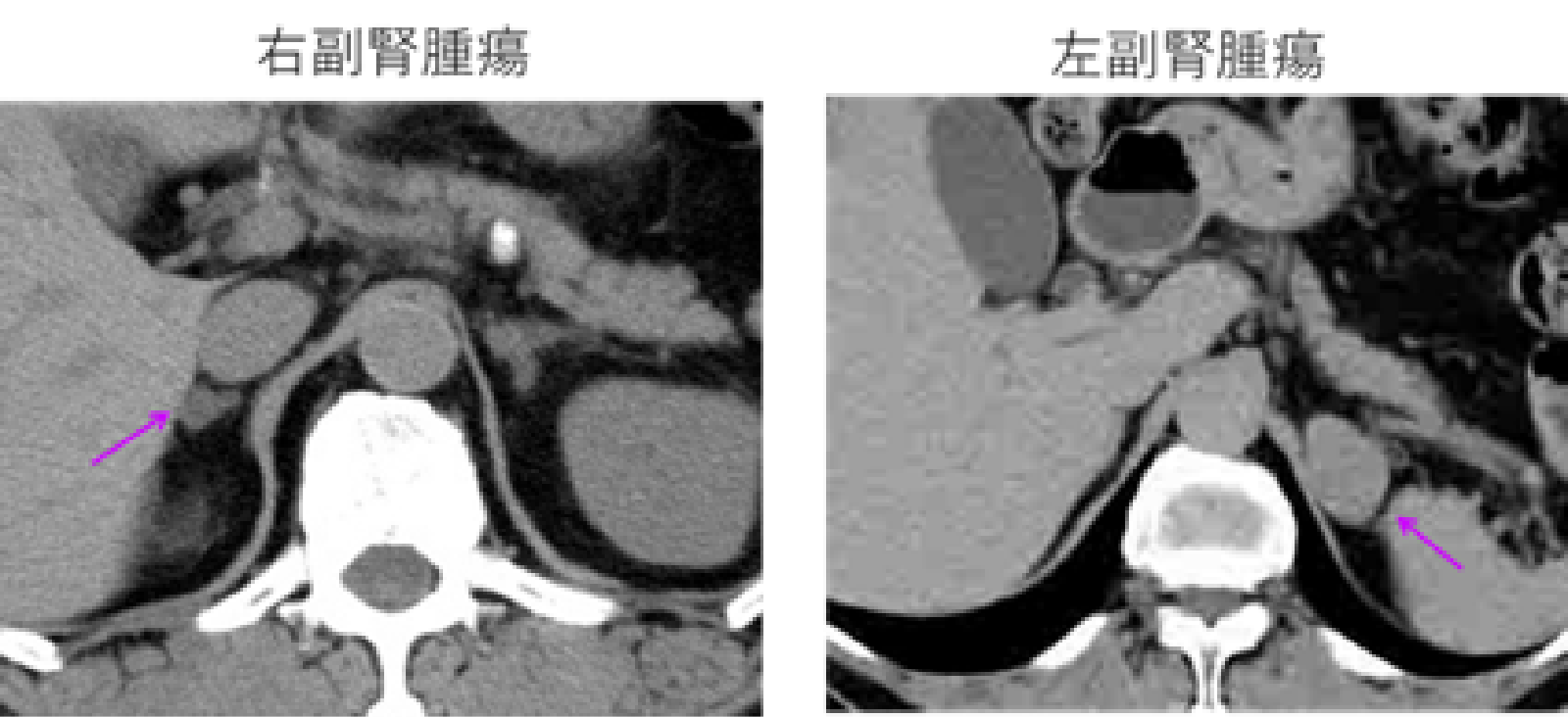
原発性アルドステロン症の治療方針の決定、すなわち病変部位を確認するためには、副腎静脈血サンプリングという検査が必要になります。副腎静脈サンプリング検査とは、足の付け根からカテーテルという細い管を静脈に挿入して、左右の副腎静脈にそれぞれカテーテルを挿入して血液を採取し、アルドステロンの濃度を調べる検査です。その結果、病変が一側性(腫瘍)か両側性(過形成)かどちらの副腎からアルドステロンが過剰に分泌されているのか調べます。ただ、副腎静脈血サンプリング自体が大変難しい手技であり、右副腎の成功率は70%しかないそうで、ゴールデンスタンダードにはなりにくく、技術的に上手く取れなかったから出ないのか、ちゃんと取れていて出ないのか、データを読む術者がわかってないと訳のわからないことになる(出なかったから否定できるものでもない)
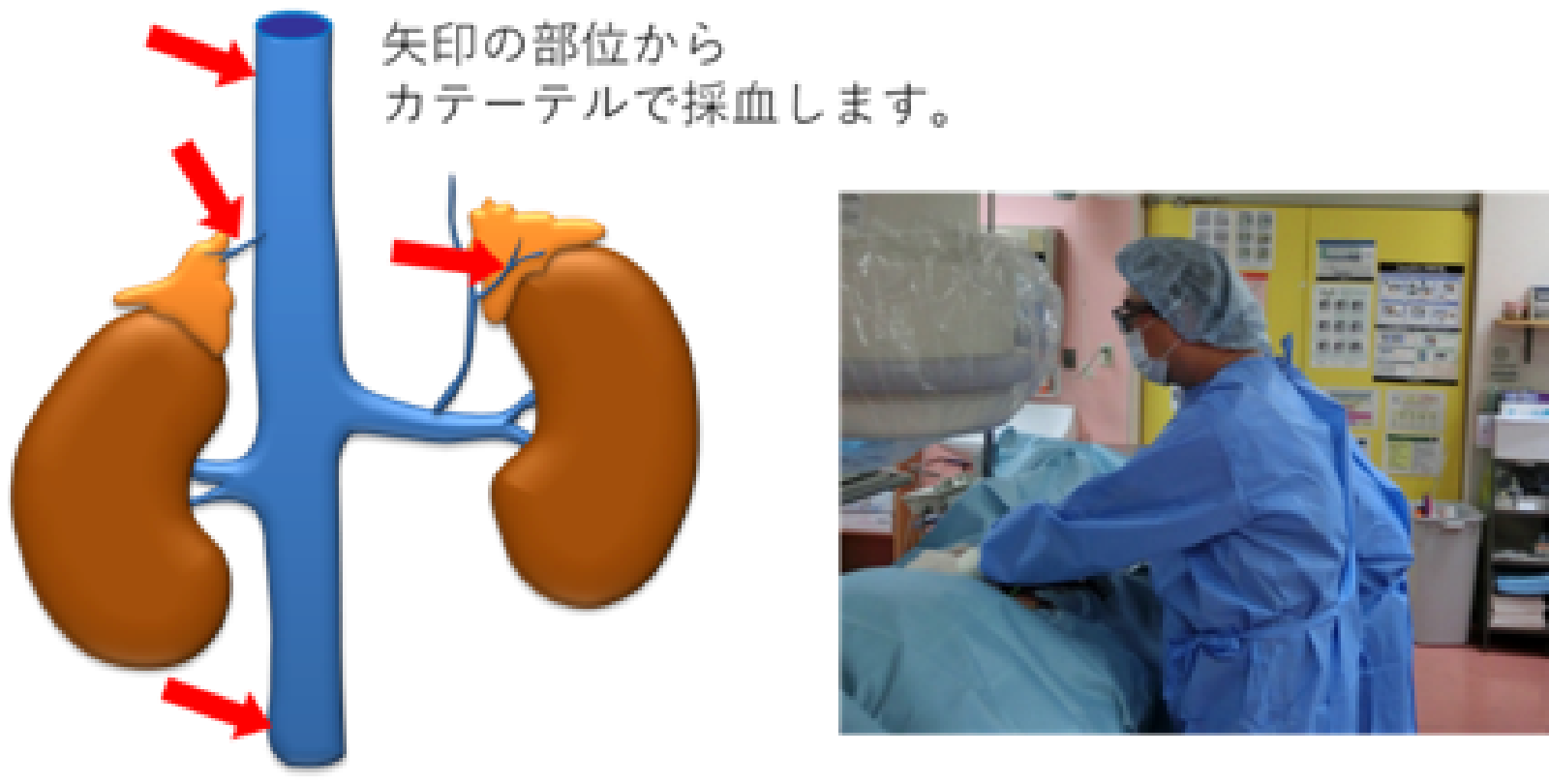
原発性アルドステロン症と診断されても、手術の適応かどうかは分かりません。手術を希望される場合は、腹部造影CTを行ったうえで副腎静脈サンプリングという検査を入院(2泊3日)で行い、手術適応を確認します。手術適応は「片側性」の場合となります。「両側性」の場合や手術を希望しない場合には、内服による抗アルドステロン治療を行います。
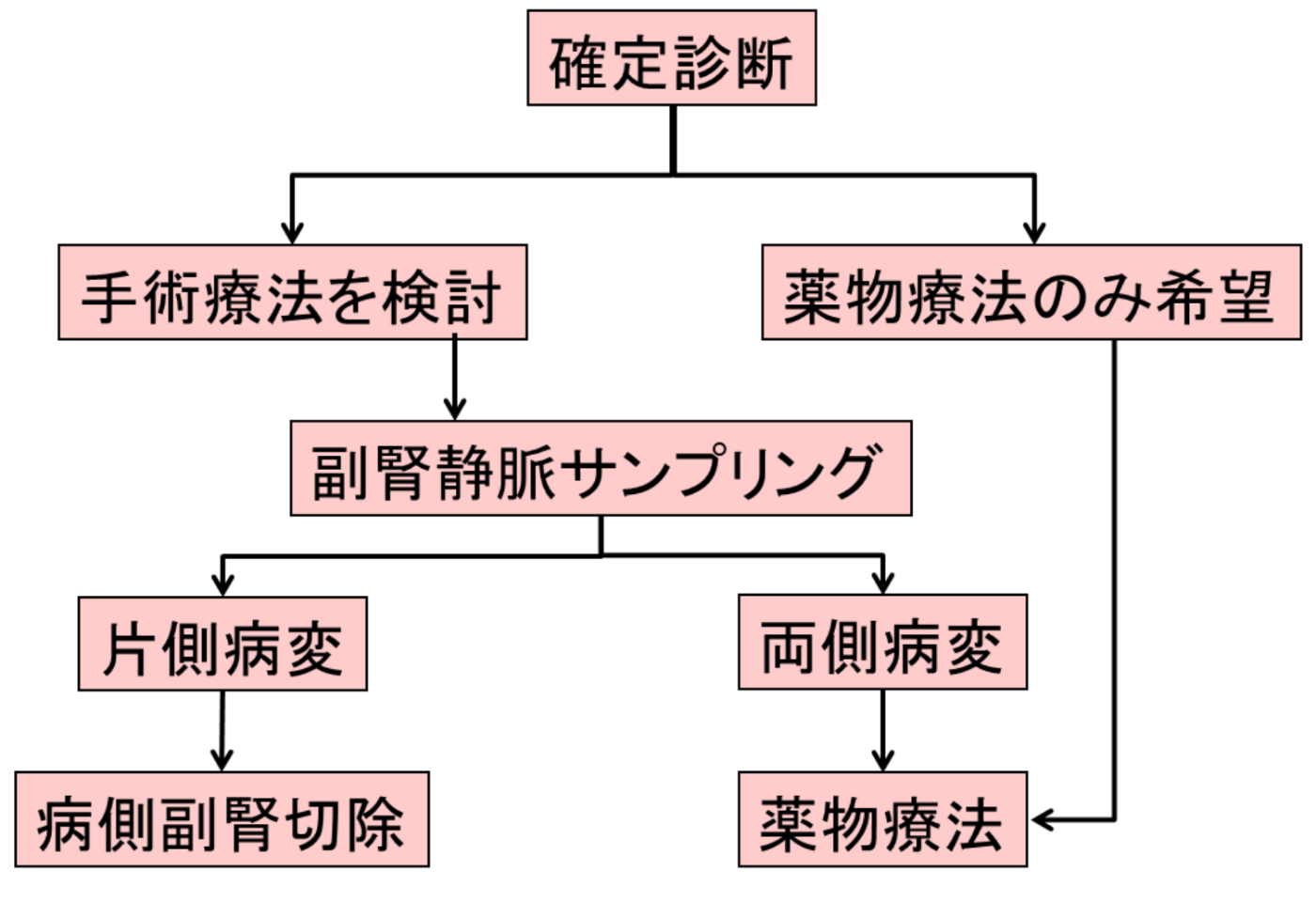
治療
副腎静脈サンプリング検査で両方の副腎からアルドステロンが過剰に分泌されている場合(両側性病変や左右両側副腎の過形成)両方の副腎を摘出することはできないため薬物療法の適応となります。過剰なアルドステロンの作用を抑える(ミネラルコルチコイド受容体拮抗薬)ためにスピロノラクトン(アルダクトンA)エプレレノン(セララ)エサキセレノン(ミネブロ)などのアルドステロン拮抗薬が第一選択として用いられ、原則生涯にわたって内服を続ける必要があります。(スピロノラクトンは50mg,経口,1日1回から開始し,通常は維持量である約100mgまで1~3カ月かけて増量する。また、エプレレノンを50mg,経口,1日1回から200mg,経口,1日2回まで)また、アルドステロン拮抗薬のみでは血圧のコントロールができない場合は、必要に応じて他の降圧薬を併用投与します。なお、通常の降圧治療のみでは、血圧値は仮に正常化してもアルドステロンによる臓器障害の本当の危険性は回避出来ません。
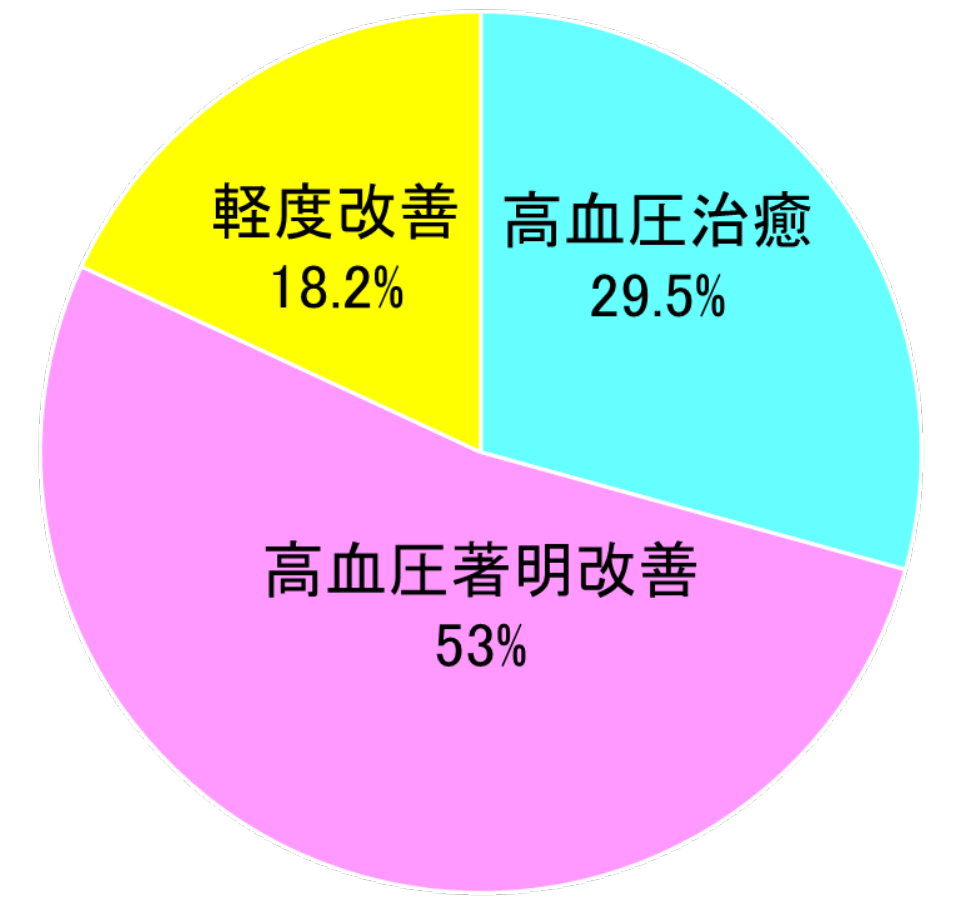
副腎静脈サンプリング検査の結果、左右いずれかの副腎に限局した病変である場合は、通常は泌尿器科で腹腔鏡下副腎摘出術によって、原因となる副腎を摘出します。副腎は片側のみでも充分に機能するので手術後も身体へ全く影響はありません。腹腔鏡下手術とは、腹部に4箇所の小さな穴を開け、そこから腹腔鏡(棒状のカメラ)と手術器具を入れて、モニター画面を見ながら行う手術です。傷が小さく術後の痛みが少ない、通常翌日から食事や歩行が可能になります。外科手術によって腫瘍を取り除くことで、高血圧も治癒する症例は約半数といわれています。特に高血圧罹患歴が短い人や若年女性では高血圧の治癒が多くみられます。手術により腫瘍の摘出を行えば、多くの症例で血圧は徐々に低下します。また、腫瘍が小さいうちに手術するほうが治癒率は高くなります。しかし、診断が遅れて高血圧の罹病期間が長い場合(70歳以上)や合併症が生じた後で手術をしても結局は降圧剤が止められない症例もあります。
原発性アルドステロン症手術例における高血圧の改善度
どこまでするのが現実的に妥当か
原発性アルドステロン症の診断するためには、アルドステロン・レニン比:ARRを可能な限りは全例にというのが理想ですが、医療経済上の保険診療(5400円)の査定もありますし、特にリスクの高い群で測定するのを目標にします。ARR>200以上で原発性アルドステロン症が疑われても、腹部CTで腫瘤が見つからない場合に副腎静脈血サンプリングまでするかどうかは、ケースバイケースです。患者さんの意向にもよりますが、CT陰性の場合の多くは両側性なので、血圧のコントロールに難渋しなければ薬物療法で様子を見るのが現実的かもしれません。最近報告されている微少腺腫の診断治療には、内科(スクリーニング・診断)放射線科(画像診断、副腎静脈サンプリング)泌尿器科(腹腔鏡下副腎手術)病理部(最終的な組織診断)の4部署の密接な連携が必要です。つまり、原発性アルドステロン症をしっかり診断するためにはマンパワーがいるわけですが、現実問題として、たつの市周辺で紹介するにしてもはり姫ぐらいでしょうか、兵庫県、近畿圏に広げても副腎静脈血サンプリングをやっている施設が非常に少ないわけで、成瀬先生(京都医療センター)のお話では、日本国内で副腎静脈血サンプリングは年間500件ぐらいが限界と言われていました。高血圧症の5%である200万人の原発性アルドステロン症の疑いのうちたった500人のキャパしかないわけです。つまり、4000人に一人しか検査できないわけでどこかに線引きが必要です。ARRはスクリーニングなのでかなり低いレベルで設定されており偽陽性も含まれますが、一方でアルドステロン値の低い原発性アルドステロン症もあるようですが、それを言い出すとキリがありません。見逃しても大丈夫?と言ってら語弊があるかもしれませんが、アルダクトンでコントロール可能な場合も多い。200<ARR<1000と機能も弱い、CTで腫瘍も見つからない、ノルバスク5mがで血圧はコントロールできる、カリウムも正常などの症例は、薬物療法で対応する。一方でARR>1000と機能も強い、CTで腫瘍も大きい、治療抵抗性高血圧、低カリウム血症がある場合は、副腎静脈血サンプリングを施行して片惻性なら手術、両側性なら薬物療法とリスクの層別化をして対応することが現実的かもしれません。