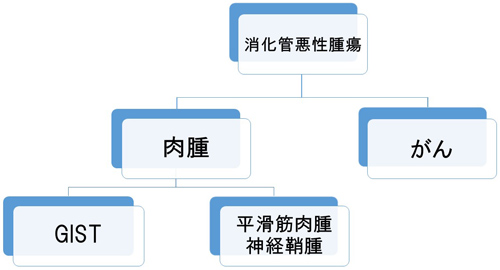
GISTは、胃や腸の消化管壁の粘膜下にある未熟な間葉系細胞に由来する「肉腫」の一種で、手術や生検で組織を確認して初めて診断できます。病理組織診断の前にGISTと診断されることはありません。多くは粘膜下腫瘍(SMT)として見つかり、すべてが悪性GISTに進行するわけではなく、良性の平滑筋腫、神経鞘腫や悪性の平滑筋肉腫などのこともあります。GISTの発症率は年間に10万人に対して1人から2人くらいとされ極めて少ない希少がんです。発症には男女差がなく、GISTが発生する部位は、胃(胃体上部、噴門直下)が60%から70%を占め、次いで十二指腸・小腸(近位空腸)が20%から30%、直腸(肛門括約筋直上)が5%程度、食道その他が5%未満です。 ほとんどの年齢層に見られますが、50~60 歳代に多く、ごく稀に小児患者もおられます。
原因
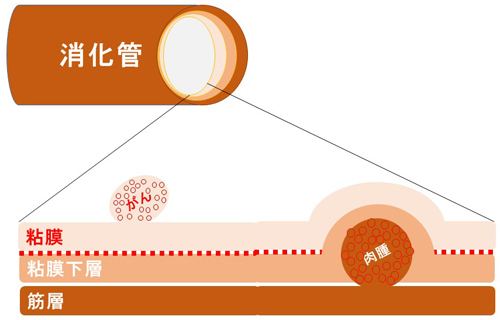
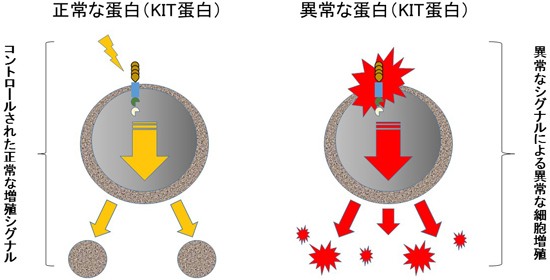
GISTは、消化管の壁の筋肉の層にある「カハール介在細胞」に生じる異常が原因と考えられています。カハールの介在細胞は、消化管壁の筋肉の層に運動の信号を出すペースメーカー細胞で、この筋肉層の伸縮により食物が口から肛門へ運搬される。カハールの介在細胞には KITという蛋白があり、正常 KIT 蛋白は、外からの必要に応じた「増殖指令」を受けて「増殖せよ」という情報を細胞内に伝達しています。GISTの発生原因は、主に血小板由来増殖因子受容体(PDGFR)ファミリーに属するチロシンキナーゼKIT、またはPDGFRAをコードする遺伝子の変異で、GIST全体の80%にKIT、10%にPDGFRAの変異が確認されています。これらの遺伝子に変異がないおよそ10%の野生型GISTでは、コハク酸脱水素酵素(SDH)の欠損または非欠損に分けられます。しかし、遺伝子変異が、必ずしも悪性化の原因とは言えませんが、この突然変異した異常 KIT 蛋白が、外からの指令がなくて も「増殖せよ」の情報を伝え続けてしまう結果、異常 KIT 蛋白を持った悪い細胞が増え続け、GIST を生じると考えられています。それぞれの遺伝子変異は、GISTの発生部位や組織型、悪性度などの特徴との関連性がある程度認められてます。GISTのほとんどは遺伝子しません。
症状
症状は、吐き気や腹痛、下血・吐血やそれに伴う貧血などが起こることもありますが、他の病気でもあらわれる症状ばかりで、GIST特有の自覚症状は特にありません。GISTは胃がんや大腸がんに比べて症状が現れにくく、また症状があっても軽度であることが多いため、診断が遅れ病気が進んでから発見されることも少なくありません。
診断
診断は、通常、検診で粘膜下腫瘍(SMT)が疑われる所見が認められた場合、または何等かの症状を自覚した場合に医療機関を受診しますが、いきなりGISTと診断されることはありません。「粘膜の下に腫瘤(SMT)がありますよ」といわれることから始まります。CTやMRI、内視鏡などによる画像診断で大きさや転移・浸潤などを確認します。GISTの診断は、病理組織で行います。内視鏡や手術などで病変の組織を採取し、一般的なヘマトキシリエオジン(HE)染色像でGISTに特徴的な紡錘型細胞、または類上皮型細胞が確認されたら、KIT蛋白に特異的な染色方法でKIT 蛋白が存在している場合を消化管間質腫瘍(GIST)と診断します。いずれの組織型でも、KIT陽性の場合はGISTが確定しますが、KIT染色が陰性もしくは弱陽性の場合は、GIST細胞が特異的に発現する蛋白質DOG1(Discovered on GIST1)の染色、およびKITとPDGFRAの遺伝子変異の検査を組み合わせ、GISTか否かを判定します。GISTの確定診断は一般医療機関では極めて難しく、専門家の協力が欠かせないことから、病理コンサルテーションシステムなどを利用して正確な診断をすることが重要な第一歩です。
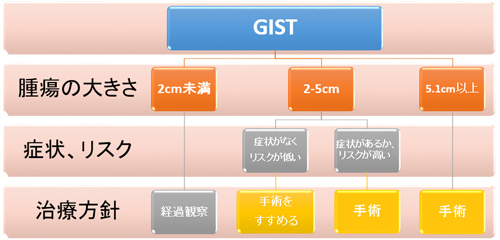
また、GISTの診断は、手術で切除した摘出組織の病理診断により判定されることもあり、治療も兼ねて行われます。未診断のSMTが原因と考えられる自覚症状がある場合は、GISTか否かに関わらず、まずは症状を取り除くために手術をします。また、症状がなくてもSMTの腫瘍径が5cmを超えている場合は、悪性の可能性が高いため、明らかに良性と判断できる場合を除き手術で切除し、病理診断によりGISTか否かを判定します。腫瘍径が2cmから5cmの場合は、CTや超音波内視鏡の所見、および超音波内視鏡下穿刺吸引生検で採取した組織の病理診断により精査し、GISTか否かを判定します。腫瘍径が2cm未満の場合は、内視鏡検査で悪性所見を確認し、EUS-FNABの病理診断でGISTか否かを判定します。悪性所見がなければ定期的な検査で経過観察をします。日本のガイドラインでは、確定診断されたGISTは腫瘍径に関係なく手術で切除することが推奨されていますが、現実的には、2cm未満のSMTをGISTと確定診断できる確率は低く、仮にGISTと判定しても、悪性度が明らかに高いと予想されるもの以外は手術不要としている専門医もいます。手術の要不要と経過観察に関するエビデンスはほとんどないのが実情です。
治療
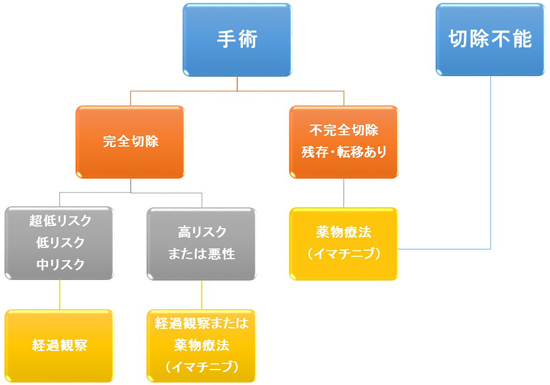
GISTの治療では、基本的には手術が最も有効ですので「完治」を目標とし、第一選択は手術です。手術は腫瘍の大きさ、症状の有無、増大傾向、リスク分類に応じて行います。GISTは胃がんや大腸がんと比べると浸潤傾向が少なく、リンパ節転移もまれなので、多くの場合は腫瘍の切除において切除臓器の機能温存を考慮した部分切除が行われます。腫瘍の大きさで治療方法が異なります。腫瘍が2cm 以下のすぐに手術せずに定期的に観察し様子見ます。腫瘍が 2〜5cmなら手術がすすめられるが、患者さんの意思尊重。開腹手術ではなく腹腔鏡下手術も可です。 腫瘍が5cm 以上は手術が必要。開腹手術が勧められます。しかし、手術が成功しても薬物治療をしなければ 3 人に 1 人の割合で再発します。 3cm以上のKIT蛋白陽性GIST患者において、完全切除が得られた場合、薬物治療を併用しなければ、1 年無再発生存率は67%、グリベック服用群すれば、1 年無再発生存率96%と報告されています。GISTは手術で、完全切除により半数以上の患者さんは根治しています。術後は、リスク分類に基づき治療方針が決まります。リスク分類は複数ありますが、日本では主に「Modified NIH」を用い、高リスクまたは腫瘍破裂のGISTの場合はイマチニブによる術後補助療法を行います。中・低リスクのGISTを完全切除した後は、通常は定期的なCT検査による経過観察となります。また、手術で腫瘍が完全に取り除けなかった場合や、なんらかの理由で手術ができない場合もしくは他臓器に多くの転移がみられる場合などはイマチニブ(グリベック)が投与されます。
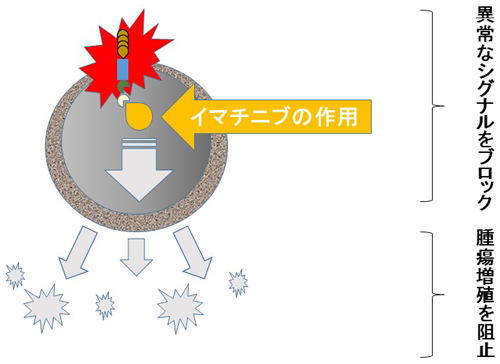
イマチニブはもともと慢性骨髄性白血病の薬として開発されました。作用機序は突然変異で異常 KIT 蛋白を標的とした分子標的薬で、この蛋白が出し続けている「増殖せよ」という指令を遮断して異常細胞を抑制します。GISTの成因としてc-kit遺伝子異常が発見され、GISTはKIT(c-kit遺伝子産物)やCD34を発現し純粋な平滑筋(肉)腫や神経鞘腫とは表現型が異なります。中でも約90%のGISTではc-kit遺伝子変異が認められ、異常なKITチロシンキナーゼ(c-kit遺伝子からできるタンパク質)を阻害するイマチニブが導入され非常に高い治療効果を示しました。
薬物療法の1次治療薬は、KITチロシンキナーゼ阻害活性を有するイマチニブ(商品名グリベック錠)で、成人は1日400mgまでの内服が保険適用されています。定期的なCTまたはPET検査による効果判定で、完全奏効(CR)、部分奏効(PR)、または病勢安定(SD)の効果が得られた場合は、そのまま内服を継続します。腫瘍が増大し病勢進行(PD)した場合、そのGISTはイマチニブ耐性と判定され、2次治療薬のスニチニブ(商品名スーテントカプセル)に切り替えます。スニチニブでも効果なしと判定された場合は3次治療薬のレゴラフェニブ(商品名スチバーガ錠)に切り替えます。いずれにしても耐性の診断は慎重に行い、切り替えのタイミングを決定する十分な根拠が提示される必要があります。さらに、レゴラフェニブでも効果が得られない場合は、効果ありの経験がある薬剤に戻って再治療を試みる、新薬の臨床試験に参加する、積極的治療をせずに経過観察、あるいは緩和ケアなど、全身状態や希望を考慮しつつ選択することになります。幹細胞因子受容体KITのチロシンキナーゼを阻害するイマチニブの治療成績は、奏効率は50%から70%、持続的な病勢安定を含めた病勢コントロール率は85%から90%とされています。術後補助療法としての効果の指標である無再発生存期間は、術後補助療法を行わないプラセボ群と比べ有意に延長し、再発リスクをおよそ60%低下させることが報告されています。KITの他、PDGFRAや血管増殖因子受容体(VEGFR)など複数のチロシンキナーゼを阻害するマルチキナーゼ阻害薬のスニチニブでは、イマチニブが効かなくなった後、効果が得られるのはおよそ40%、腫瘍が小さくなるのはおよそ7%とされています。イマチニブが耐性、または不耐容と判定された患者を対象とする第3相試験では、薬物治療を行わないプラセボ群と比べ増悪、または死亡のリスクを70%近く低下させることが報告されています。レゴラフェニブは腫瘍形成に関わるKIT、BRAFなどを阻害するのに加え、遺伝子変異のあるKITにも阻害活性を発揮します。イマチニブとスニチニブによる治療後に増悪した切除不能、または転移性のGIST患者を対象とする第3相試験では、薬物治療を行わないプラセボ群と比べ増悪、または死亡のリスクを70%以上低下させることが報告されています。
薬物治療では、腫瘍が小さくなることはもちろん望ましいのですが、現状の内科治療では再発や転移したGISTを完全に治すこと(根治)は難しく、大きくさせないことを目的としています。そのためには有害事象が許す限り服用を継続して血中濃度を維持して腫瘍量を少なく保つことで、生活の質をなるべく維持しながら、可能な限り長く効かせて治療を継続することが重要になります。また、GISTで使用されるイマチニブ、スニチニブ、レゴラフェニブなどの分子標的治療薬の副作用は、吐き気、皮膚の発疹、むくみ(50%)体重増加、下痢、発熱、重度の悪寒、喉痛、口内炎、筋肉痛、筋痙攣、腹痛、貧血など多岐にわたります。有害事象が発現した際の対処法や、発現を予測しての予防法を知っておくことも、休薬せずに服用を継続することにつながります。イマチニブで最も多い有害事象である浮腫は、食塩摂取量が影響をおよぼすことから、日々の食事での減塩が必要です。浮腫の重症度に応じて利尿剤が処方されることもありますが、まずは自身で減塩を意識したコントロールを心がけましょう。スニチニブやレゴラフェニブでは、皮膚変色や手足皮膚症候群が発現することが多いため、あらかじめ手足を保護するなどの予防的処置も大切で、軽度の場合は抗ヒスタミン薬やステロイドの外用薬でコントロールすることができます。
再発、または転移があるGISTの標準治療は薬物療法です。診断時に転移が確認され切除不能と判断された場合、手術から術後補助療法の間に再発や転移が確認された場合、または最初の手術での不完全切除のGISTが薬物治療の対象に含まれます。なお、GIST手術後の最初の再発はほとんどが腹腔内(肝臓または腹膜)です。