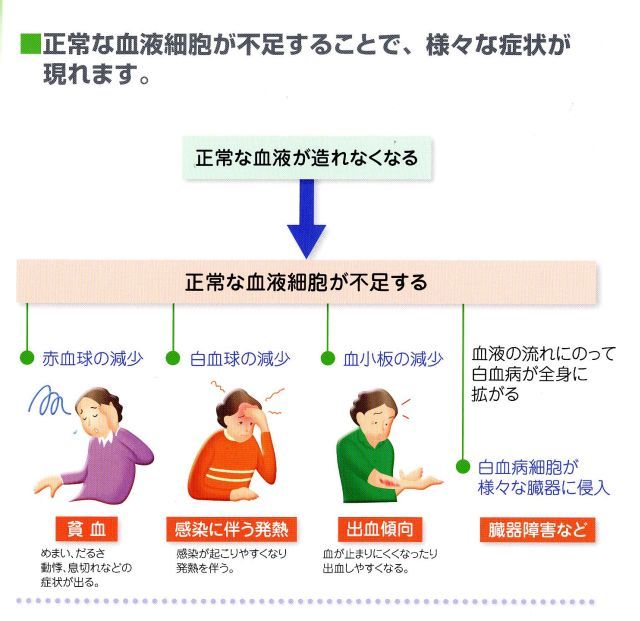
白血病は「血液のがん」ともいわれ、遺伝子変異を起こした造血細胞(白血病細胞)が骨髄で無秩序に増殖して、白血病細胞が造血の場である骨髄を占拠するために(正常な白血球や赤血球、血小板を作る場所がなくなる)正常な造血を阻害して、感染症(白血球減少)や貧血(赤血球減少)出血症状(血小板減少)などの症状が出やすくなり、多くは骨髄のみにとどまらず血液中にも白血病細胞があふれ出て、白血病細胞がさまざまな臓器に浸潤(侵入)して障害することもある。急速に進行する急性白血病と、ゆっくり進行する慢性白血病に大きく2つに分類され、さらにそれぞれ骨髄系細胞から発生する骨髄性白血病と、リンパ球系細胞から発生するリンパ性白血病に分けられます。

慢性骨髄性白血病(CML)は、急性骨髄性白血病(AML)が慢性化した病気ではありません。急性骨髄性白血病(AML)と慢性骨髄性白血病(CML)では病気の進み方も異なります。急性骨髄性白血病(AML)の場合には初期から症状があらわれ、直ちに入院治療を必要としますが、慢性骨髄性白血病(CML)の場合は、初期には症状がないか、あっても軽い場合が多く、進行すると急性白血病と同じような症状があらわれます。
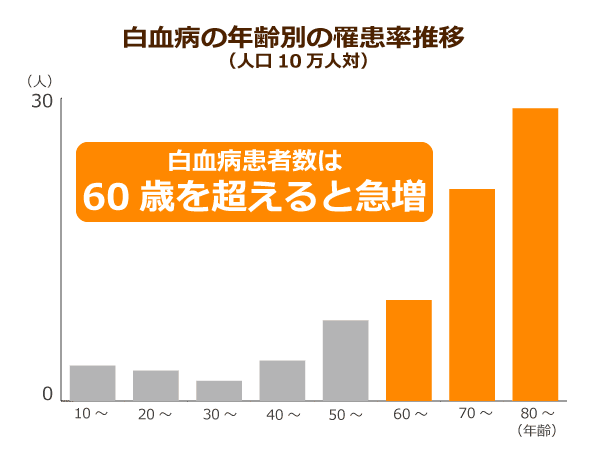
小児白血病など幼い子どもから若い人でも白血病を発症するケースは少なからずありますが、2016年の全国がん登録の概要によれば、年代ごとの発病者数は、人口10万人当たりの発病者数は、0~4歳だと8.8人、5~9歳だと4.9人、10~14歳だと3.0人、15~19歳だと4.1人ですが、一方、高齢世代になると、60~64歳では16.3人、70~74歳で28.7人、80~84歳で44.9人にまで上昇し、60歳以上が全体の7割近くも占めています。
急性白血病の診断は、骨髄における白血病細胞が顕微鏡で見て20%以上であれば急性白血病を診断します。増加している白血病細胞が表面マーカー検査で骨髄球系かリンパ球系か調べて、骨髄系なら急性骨髄性白血病、リンパ球性なら急性リンパ球性白血病と診断します。骨髄性もリンパ球性もほとんど症状は同じですが、急性リンパ球性の白血病の方が中枢神経浸潤をきたしやすい傾向にあります。
検査
(1)血液検査
(2)骨髄穿刺
皮膚を消毒し局所麻酔の後に腰の骨に細い針を刺して骨の中になる骨髄液を注射器で吸引して採取します。この骨髄中に含まれる細胞の形を顕微鏡で調べます。染色体検査や緯線試験さ、細胞表面マーカー検査などを行います。
細胞表面マーカー検査:細胞の表面の抗原(細胞の起源や性格を示すいろいろな目印、蛋白質)を解析する方法でフローサイトメトリーという器械を使います。この検査により顕微鏡で観察しただけでは判断がつかない腫瘍細胞のタイプを見分けることが可能になる。
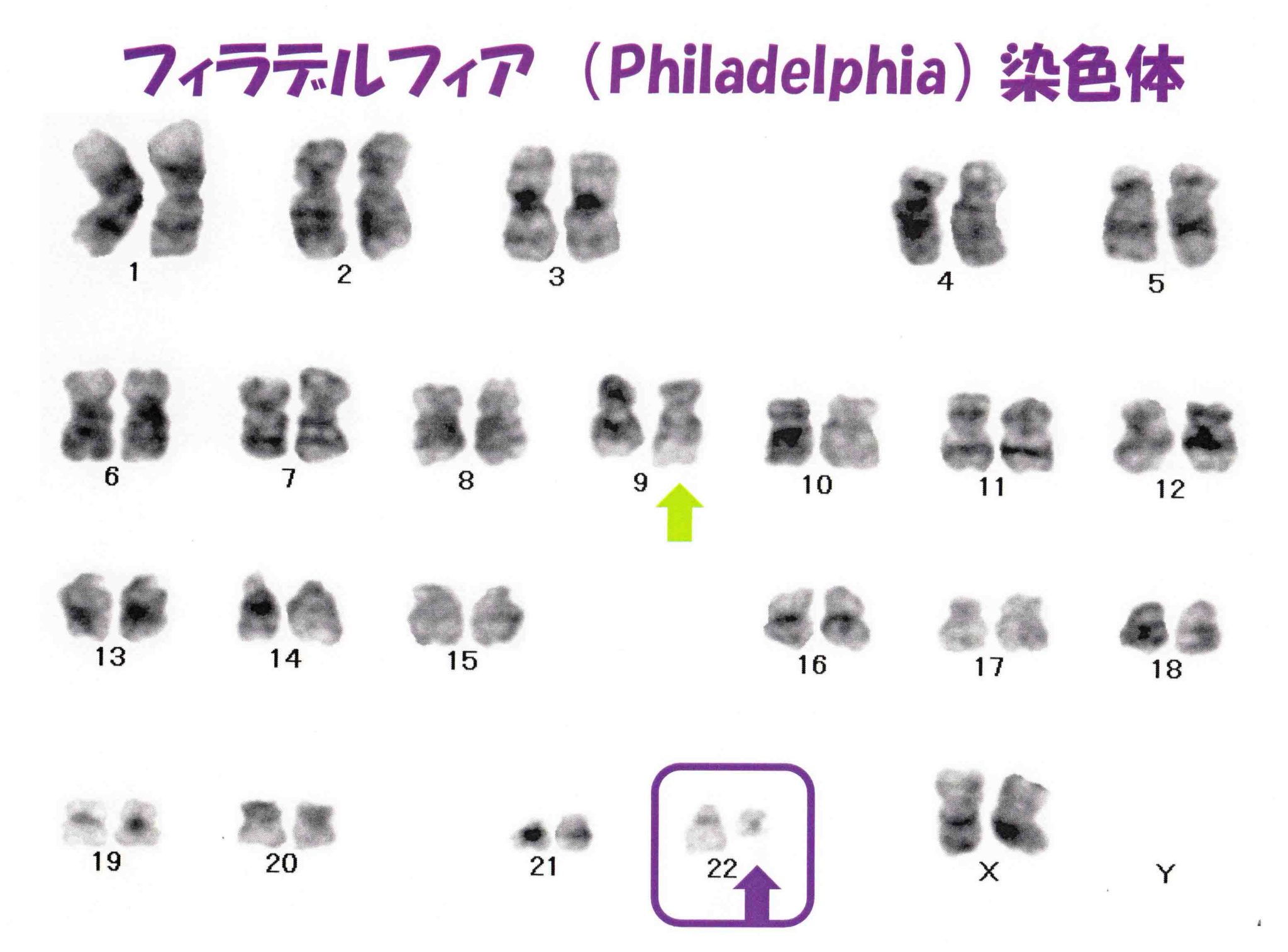
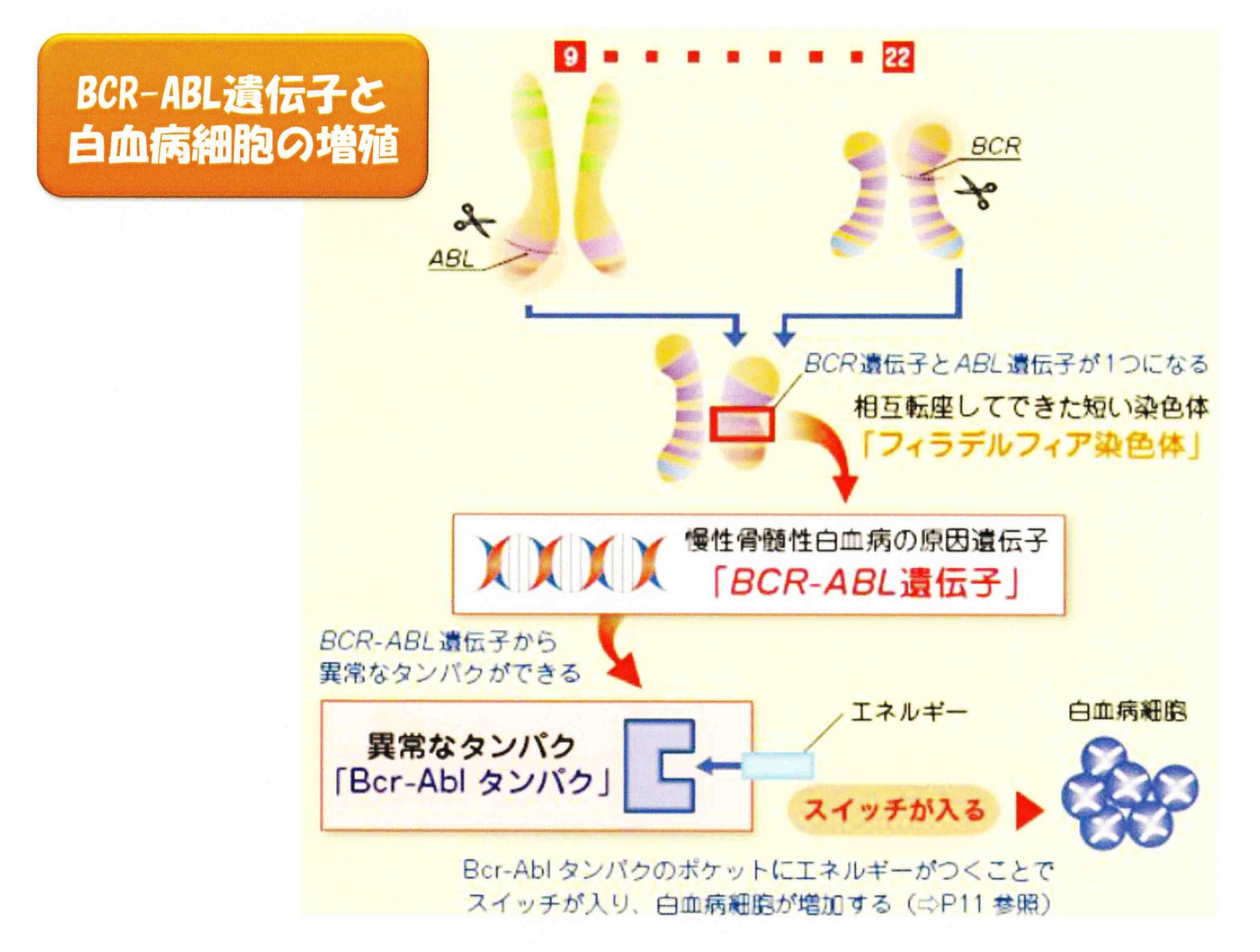
染色体検査:骨髄の細胞をつかって染色体の数と形態以上を検索する検査で採取した細胞を分裂させて調べます。フィラデルフィア染色体では、第9染色体と第22染色体の組み換えによって本来離れている第9染色体のAbl遺伝子と第22染色体のBcr遺伝子が隣り合わせになってAbl/Bcr遺伝子ができるといわゆるフィラデルフィア染色体陽性白血病になります。
様々な検査をした後に、遺伝子異常や特定の染色体異常の有無などによる新WHO分類に従って診断をします。
なぜ、
をでは、多い順番で解説して行きます。
急性骨髄性白血病
予後を予測するのに最も需要なものは染色体核型です。染色体検査では、普通なら男性なら46xy、女性なら46xxという結果が出てくるのですが、いろんな染色体異常が見つかる場合があります。予後のいい染色体異常と予後の悪い染色体異常があります。
予後良好群は5年生存率は60%ぐらい、中間群で40%、不良群では10%ぐらいまで下がってしまいます。
慢性骨髄性白血病
慢性骨髄性白血病(CML:Chronic Myelogenous Leukemia)は、比較的ゆっくり進行する血液のがんで、骨髄増殖性腫瘍の1つに分類されます。フィラデルフィア染色体(Ph)という特異な染色体をもっており、この染色体の異常が病態の原因です。やや男性に多く、わが国における発症頻度は10万人に1~2人と比較的まれで、成人における白血病全体の約20%を占めます。
症状
白血球ががん化して白血病細胞となっても、ほぼ正常の白血球と同じ働きをする上にゆっくりと進行するため、初期の段階ではほとんど症状がみられません。一般的に30〜40歳代で発病することが多く、無症状で健康診断などで白血球数の増加を指摘され、偶然に見つかることがほとんどです。発見された時期により差がありますが、病気の進行とともに血液中の白血球数と血小板数はふえていきます。そして、白血球数が増加するに従って、貧血症状、全身の倦怠感や無気力、夜間の寝汗、体重減少、脾臓の増大による腹部膨満感などの症状があらわれます。
診断
著明な白血球像かにもかかわらず、貧血や血小板減少がなく、末梢血塗抹標本で顆粒球系細胞を多数認めることにより慢性骨髄性白血病(CML)を疑われます。
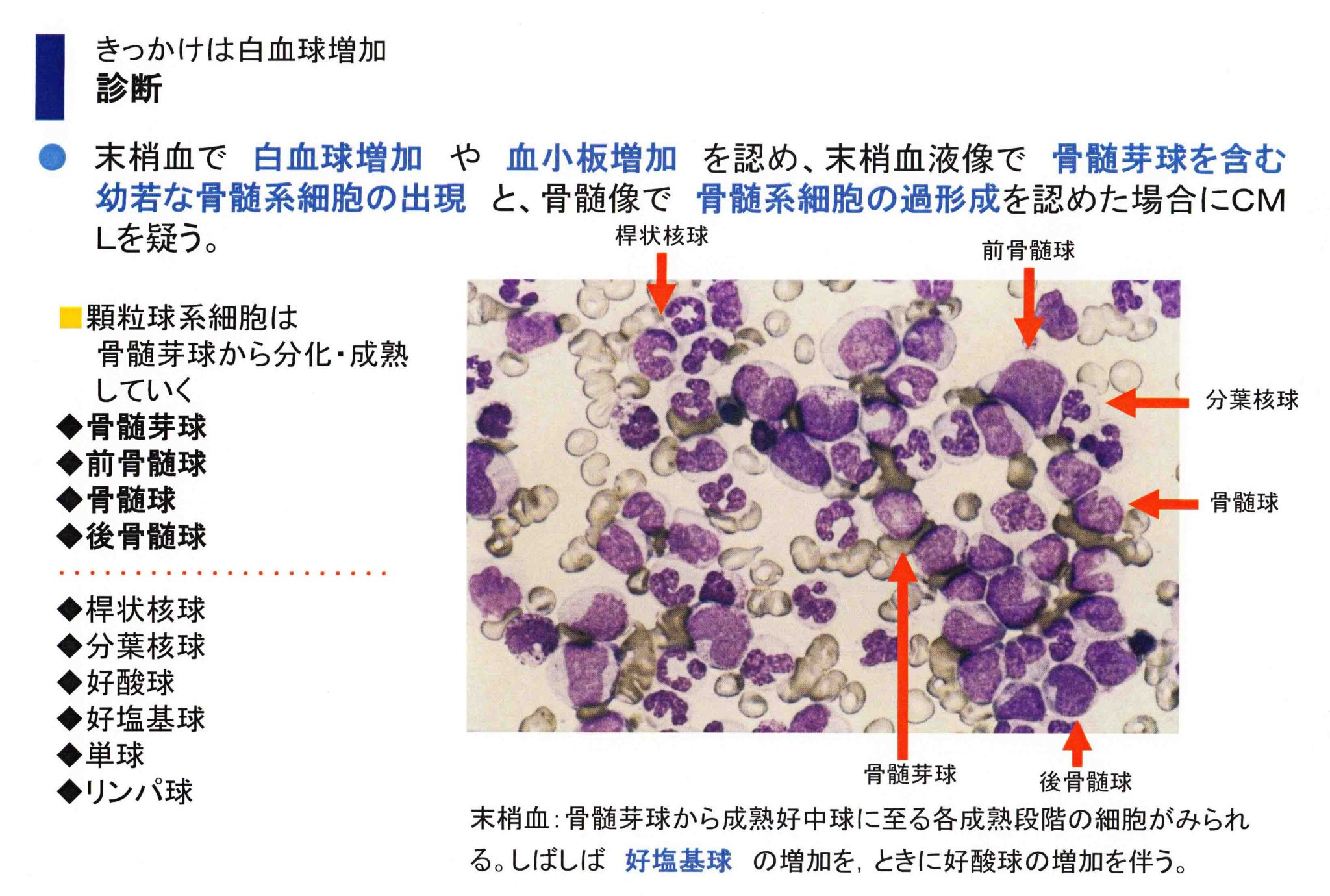
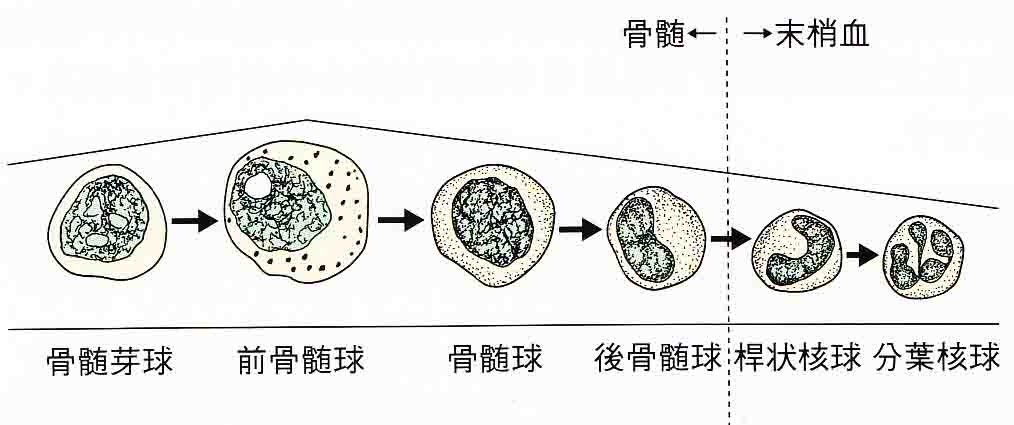
骨髄芽球(myeloblast)からこの3種の顆粒球が分化します。前骨髄球(promyelocyte)は、細胞質中に顆粒が出現した段階。骨髄球(myelocyte)は、特異な顆粒が出現し始め、細胞核クロマチンが粗くなり始めた段階。後骨髄球(metamyelocyte)は、特異な顆粒を含む細胞質となり、細胞核に凹みが見られる段階。桿状核球(stabcell)の細胞核は棒状の核となる。好中球や好酸球、好塩基球は分節核細胞となり、桿状核球とあわせて末梢血中に出現する。骨髄芽球や骨髄球などを幼弱細胞は、正常では末梢血で見ることはできません。
慢性骨髄性白血病は、急性骨髄性白血病へ移行(急性転化)する前の慢性期の間に見つけて治療しなければなりません。慢性期にゆっくり白血球が増加してくると、骨髄球や後骨髄球が増えてくると同時に好塩基球増加があれば、まず慢性骨髄性白血病を考えます。
慢性骨髄性白血病の確定診断は、骨髄細胞の染色体検査からt(9:22)(q34:q11)のフィラデルフィア染色体、BCR/ABL遺伝子を同定することです。
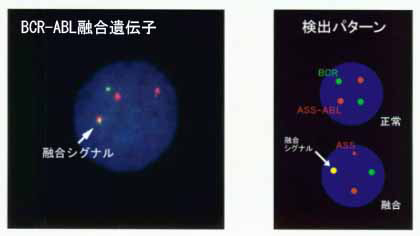
BCR-ABL融合遺伝子を視覚化して同定する方法もあります。蛍光in situ hybridization(FISH法)は、DNAの塩基配列に蛍光色素を付け、蛍光シグナルを蛍光顕微鏡で見ます。正常細胞では赤色のABLと緑色のBCRが別個に2個づつ検出されますが、BCR-ABL融合遺伝子(9:22転座陽性細胞)では、融合された黄色が1個が検出されます。
健康成人に見られた白血球増加症は、健康診断で約1〜2%に認めます。最も関連する因子は、喫煙と肥満(BMI>25)です。

寛解
血液のがん場合、よく使われる「寛解」とは? たとえば、急性骨髄性白血病では最初に、抗がん剤によって白血病細胞を叩く「寛解導入療法」が行われます。そして、骨髄中に存在する白血病細胞が5%以下になった場合を「寛解」と見なし、治療の効果があったと判定します。しかし、これだけでは白血病細胞が再び増えるかもしれないので、さらに「地固め療法」と呼ばれる追加の抗がん剤治療などを行います。これによって血液検査をしても白血病細胞が検出できなくなり、白血病が再び暴れ出す(再燃する)ことがない状態になった場合を「完全寛解」と呼びます。一般的に寛解とは、現在できうる医学的な検査、画像診断、内視鏡検査、血液検査などすべてやっても体のどの部位からもがんの病変がみつからない状態を言います。ただ、寛解=治癒と同義語ではありません。寛解という言葉には「完全に治った」とは言い切れないけれど、「病気を抑えることができている」というニュアンスがあります。どういった場合に便宜上、治癒、完治と言っているかというと5年から10年無治療で寛解を維持できた患者さんを治癒した可能性があると表現しているのが現状です。
「骨髄移植」という言葉の方がわかりやすいかもしれません。造血器腫瘍(白血病やリンパ腫など)は抗がん剤や放射線療法がよく効きますが、これだけでは根治しない人もたくさんいます。抗がん剤は、がん細胞だけでなく正常細胞も障害するためどんどん増やしていくとがん細胞は全滅できても、正常の骨髄もおおきなダメージを受けて再起不能に陥ります。しかし、そこで造血幹細胞移植を行うとそこから正常な白血球、赤血球、血小板などが作られるようになるわけです。つまり、もともとあった骨髄の細胞を抗がん剤で叩ききってしまっても移植した幹細胞から白血球が増えてくるので普通ならあり得ない様な強い抗がん剤治療も可能になる、これが造血幹細胞移植の目的です。造血幹細胞移植とは、血液がん(急性・慢性骨髄性白血病、急性リンパ性白血病、骨髄異形成症候群、多発性骨髄腫、非ホジキンリンパ腫など)の治療で広く行われています。
造血幹細胞移植はどこから造血幹細胞をとってくるかによって3種類に分けられています。以前は造血幹細胞は骨髄にあるので骨髄穿刺をして造血幹細胞をとっていたので造血幹細胞移植=骨髄移植だったのですが、1990年代から他の方法でも造血幹細胞をとってくることができるようになり、造血幹細胞移植という言葉で呼ばれるようになっています。末梢血幹細胞移植と臍帯血(へその緒)移植です。
(1)骨髄移植
(2)末梢血幹細胞移植
(3)臍帯血移植

造血幹細胞
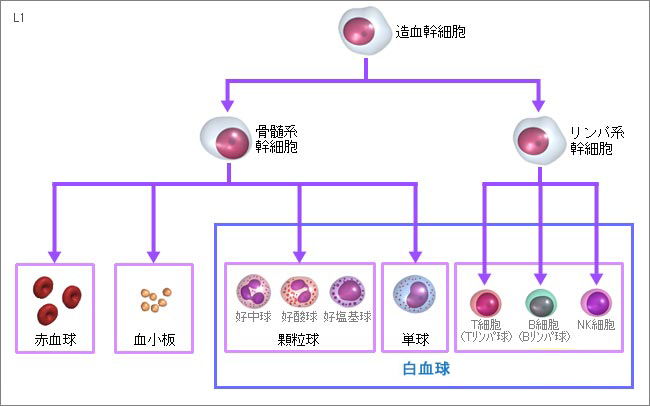
血管の中には、赤血球や白血球、血小板などが流れています。あらゆる血液細胞は骨髄(出生後から10歳代までは全身の骨の骨髄で造血が行われていますが、20歳前後からは、体の中心部にある胸や腰の骨などの限定された骨髄でのみ、造血が行われるようになります)の中でできています。骨髄に存在する造血幹細胞は魔法の細胞で、自らもコピーして自己複製して増えることもできるし、すべての血液細胞にも分化できる能力も持っています。理論的には、造血幹細胞造がひとつあれば、すべての血液細胞を一生作り続けることができるわけです。造血幹細胞は、骨髄という学校の中で、人間が大人になって職業を持つように、だんだんと小学生では、骨髄細胞系やリンパ球系に分化し、中学生、高校生となるとさらに分化してゆき、やがて大人になると赤血球、白血球、血小板へと職業につくようにいろいろな血液細胞に分かれていきます。
もうひとつの分け方は、造血幹細胞を誰から頂くかによって2種類あります。自分の造血幹細胞を使うのが自家造血幹細胞移植と他人からもらうのが同種造血幹細胞移植です。る骨髄移植や自家末梢血幹細胞移植を合わせて指す言葉で、特に難治性の血液疾患に対する根治療法として有効な内科的治療法です。

HLA型(Human leukocyte antigen:ヒト白血球抗原)
赤血球にABO型があるように、白血球にも様々な型があります。白血球の型はHLA型と呼ばれ、ABO型と同じように親から遺伝するが、その型の数ははるかに多い。HLA型は「自己」と「非自己」の識別などの免疫反応に重要な役割を果たし、移植などの治療において、患者とドナーのHLA型が異なると免疫細胞は他人であると判断して、拒絶やGVHDの反応が強くなる。HLA型は1954年に白血球の血液型として発見されました。その後、HLA抗原はほぼすべての細胞と体液に分布していることが分かってきました。HLAの各遺伝子は、父親と母親から1対ずつ受け継がれます。HLAアレルも同様に両親から受け継いだ2つの型が一対となり、「HLAハプロタイプ」という1つのセットを形成します。HLAハプロタイプは基本的に維持され、親から子へのHLAハプロタイプの遺伝パターンは4通りあります。HLAハプロタイプは何万通りもあるとされ、そのため非血縁者間での移植時におけるドナー探しを難しくする要因の1つになっています。
HLAをコードする遺伝子は6番染色体短腕上に位置し、全長が約4Mbの領域に密集しています。蛋白の構造、機能や遺伝子が位置する領域の違いから、大きくクラスI(A座、B座、C座など)クラスII(DR座、DQ座、DP座など)およびクラスIII領域に分けられます。臨床においてはその目的にもよりますが、特にA, B, C, DRがタイピングされています。
この治療法は、あらかじめ患者本人から採取した造血幹細胞(血液の元となる細胞)を、凍結保存して置きます。その後、大量の抗がん剤を用いた大量化学療法や放射線照射により、体内の悪性細胞や機能不全の骨髄を徹底的に根絶(移植前処置)した後、保存して置いた正常な造血幹細胞を静脈内投与することにより、骨髄の再構築をはかる治療法(自家移植)です。原因となるがん細胞を抗がん剤で死滅させた後、あらかじめ採取しておいた患者自身の造血幹細胞(血液をつくる細胞)を戻す(移植する)ことにより、正常な造血機能を回復させる。しかし副作用として、血液を作り出す骨髄の機能が抑制される為、治療後の造血機能及び免疫機能の回復が必要になります。
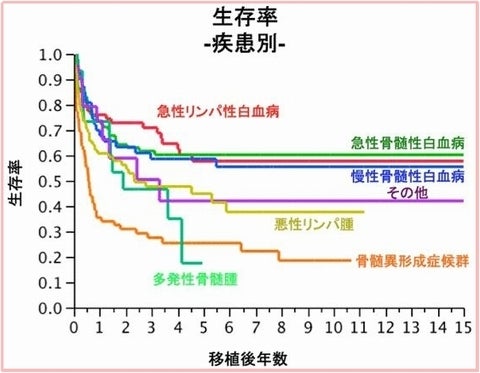
急性骨髄性白血病、急性リンパ性白血病、慢性骨髄性白血病の生存率は良好で、10年以上再発なしの場合、治癒と見なすとしていますが、骨髄異形成症候群や多発性骨髄腫、及び悪性リンパ腫(非ホジキンリンパ腫)の患者に対する造血幹細胞移植は、5年の寛解以降でも、再発するケースが目立ち、まだまだ治癒が難しい状況です。