心不全
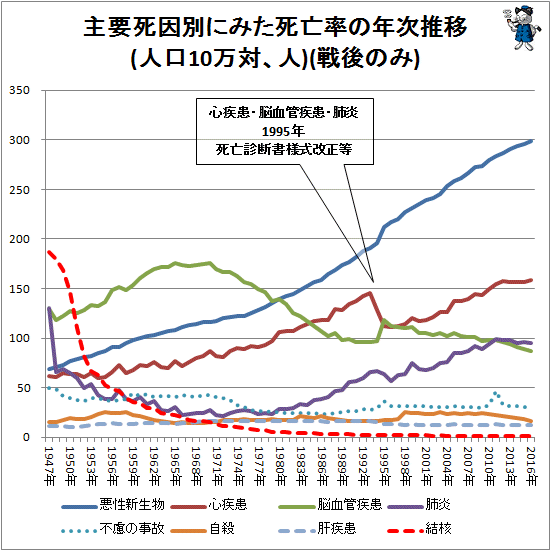
時々ニュースで「心不全」でお亡くなりになりましたとの報道がありますが、「心不全」は病気の名前ではありません。心不全とは、心臓に何らかの異常があり、心臓のポンプ機能が低下して、全身の臓器が必要とする血液を十分に送り出せなくなった状態をいいます。心臓は頑張って頑張って血液を送り出そうとしますが、最期には心臓はやがて疲れてバテてしまいます。つまり、心不全とは、心臓の血液拍出が不十分であり、全身が必要とするだけの循環量を保てない病態と定義されています。どうでしょうか?ちょっとわかりにくいですかね。疾患名ではなくて心臓がうまく働いていない状態を表しているわけです。呼吸不全(呼吸がうまくできない状態)肝不全(肝臓がうまく働いていない状態)腎不全(腎臓がうまく働いていない状態)も同じです。どんな病気にしろ最期は、心臓が止まって亡くなります。我が国の死亡原因は、第1位はがん(悪性新生物)で、第2位は心疾患ですが、平成6年から7年にかけての死亡統計で心疾患が激減しています。べつに心臓病が急に減ったわけではありません。厚生省が「死因を心不全と書かないように」と通知を出したからです。どんな疾患で死ぬにしろ、日本人の死というのは、心臓死=死としていることもあり、最後は心臓が止まって死ぬわけです。「がんにしろ脳梗塞にしろ、疾患の終末期の状態としての心不全は記入しない」といった注意書きを付けて、安易に心不全とせず、ちゃんと死亡の原因となった直接死因を書けと医師を指導したわけです。心疾患が減少しているのは、新しい死亡診断書(死体検案書)(平成7年1月施行)におけて施行前からの周知の影響によるものと考えられています。実際に監察医制度が整っている東京23区や大阪、神戸市などの地域では、必要とあれば、解剖もするので死因もはっきりします。その結果、心不全と書かれたのは、全死因の7%だったのに対し、制度のないほとんどの地域では、なんと51%が心不全だったとされています。しかし、家族が起きたら死んでいたといった異状死の場合、その人を一度も診たことがない医師が死亡死体検案書を書く時、死因ははっきりしないが、警察も事件性もないとのお墨付きを頂ければ、まあ解剖まではせずとも心不全にしておこういうことになるわけです。実際の臨床現場では、原因となる疾患でよくわからなかったら、なんでもかんでも「心不全」にしている風潮があったんでしょうね。死因は医療・保健政策をたてるうえで、基本的なデータであるので、あいまいにせずきちんと書くことは大事なので、死亡診断書にはちゃんと心臓が止まる原因となった病気を記載する努力を怠ってはいけませんね。ただ、疾患の終末期の状態としての心不全、呼吸不全等は記入しないと書かれているだけで、がんや脳梗塞、肺炎など全く異なった臓器の疾患の終末期の状態としてではなく、明らかな心疾患(陳旧性の心筋梗塞、心筋症、僧帽弁逆流など)の終末像としての「心不全」という症候名が使われることは認められています。
「心不全」とは「なんらかの心臓機能障害、すなわち心臓に器質的および/あるいは機能的異常が生じて心ポンプ機能の代償機転が破綻した結果、呼吸困難・倦怠感や浮腫が出現し、それに伴い運動耐容能が低下する臨床症候群」と定義されています。(日本循環器病学会)わかります?ちょっと難しいですよね。そこで、心不全を国民によりわかりやすく理解して貰うため、一般向けの定義として「心不全とは、心臓が悪いために、息切れやむくみが起こり、だんだん悪くなり、生命を縮める病気です」と発表(2017年度改訂)されました。
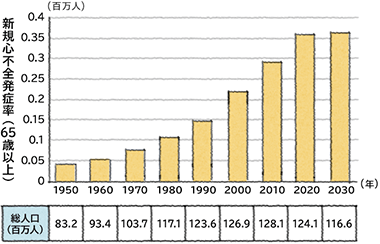
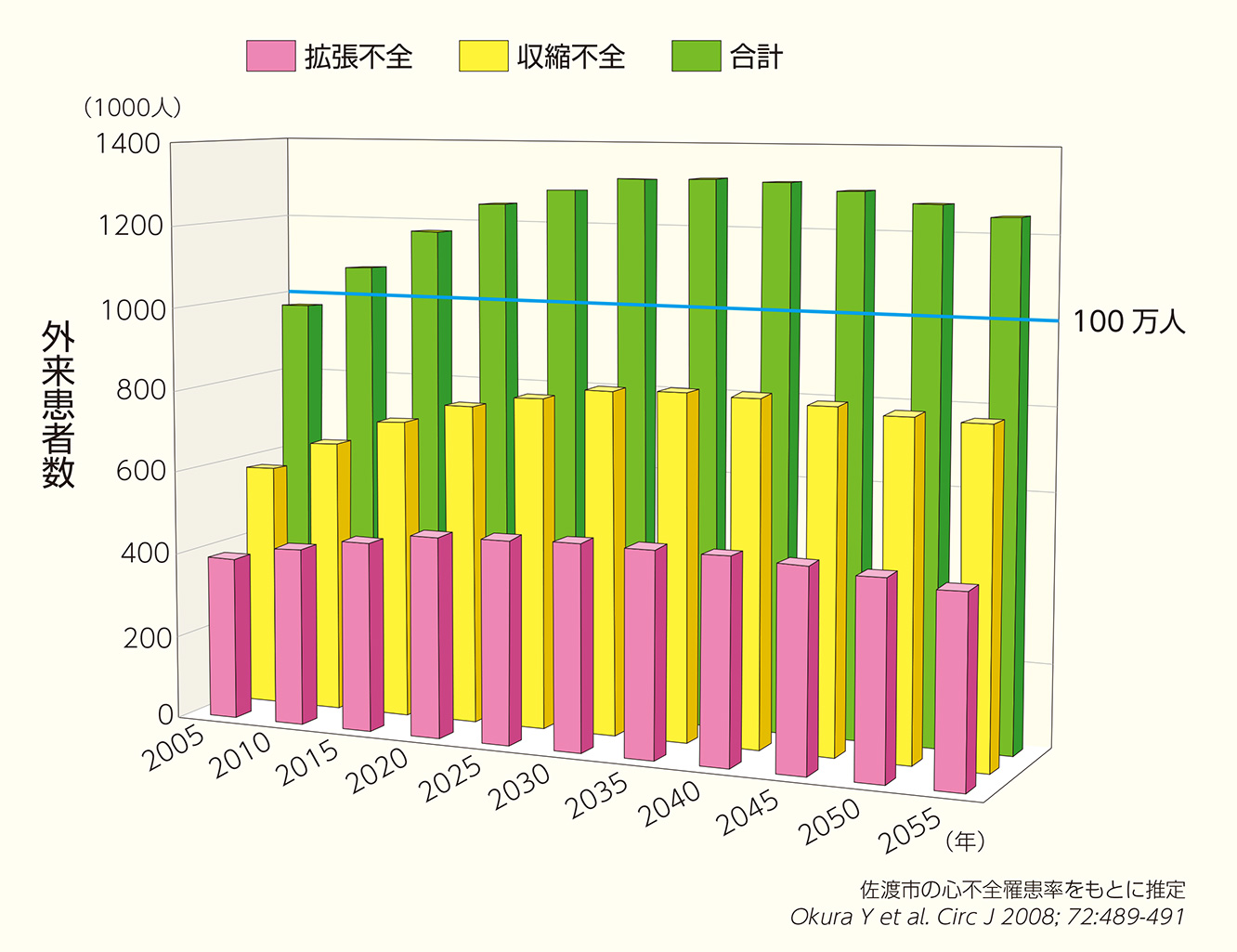
日本は世界でもトップを走る超高齢化社会であり、2025年には65歳以上の人口が30.3%、75歳以上が13.0%に達するとされています。心不全を含む心疾患にかかる患者は増加しつづけ、がんに次いで、死因の第2位を占めています。高齢者の増加に伴い、高齢心不全患者さんが大幅に増加すること=「心不全パンデミック」が予想されています。心不全が爆発的に増えるであろう背景としては、高齢化により新規心不全患者が増えることと同時に、いろいろな治療法が開発され、心不全の治療も進歩し、心不全患者さんが一旦は良くなって退院するので、何回も入退院を繰り返す患者さんが多いことから(がんのようにどこからが終末期なのかがはっきりしない)入院医療が必要な高齢心不全患者さんであふれ、心筋梗塞や大動脈解離などの救急疾患の患者さんを救急病院が受け止めきれなくなる事態が想定されているわけです。そのため、地域社会全体としてチームを組んで、外来、在宅、日常生活において心不全を予防し、再発させない治療、体制が必要です。
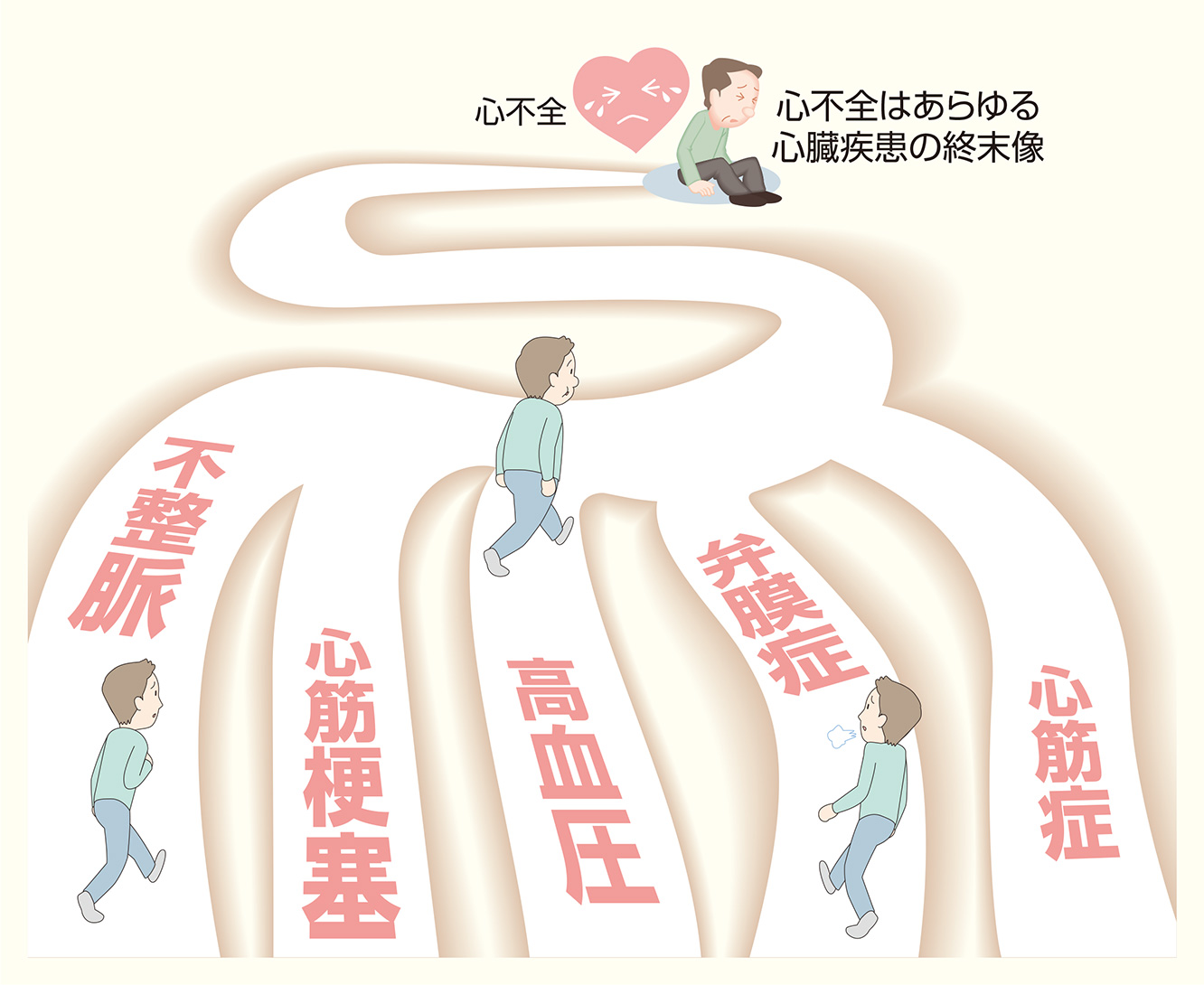
「心不全」はひとつの病気ではなく、心臓のさまざまな病気(心筋梗塞、弁膜症、心筋症など)や高血圧などにより負担がかかった状態がつづき、そのなれの果てなのです。
心不全には、急性心筋梗塞や過度なストレスにより、急激に心臓の働きが悪くなる「急性心不全」と心不全の状態が慢性的に続く「慢性心不全」があります。急性心不全は命の危機にさらされることもありますし、慢性心不全が急に悪くなり、しばしば入院治療が必要な急性心不全に移行することもありますが、入院のたびに心機能が低下し、慢性心不全として全身状態も低下していくため、高齢者の終末像としてとくに大きな問題となってきています。
症状
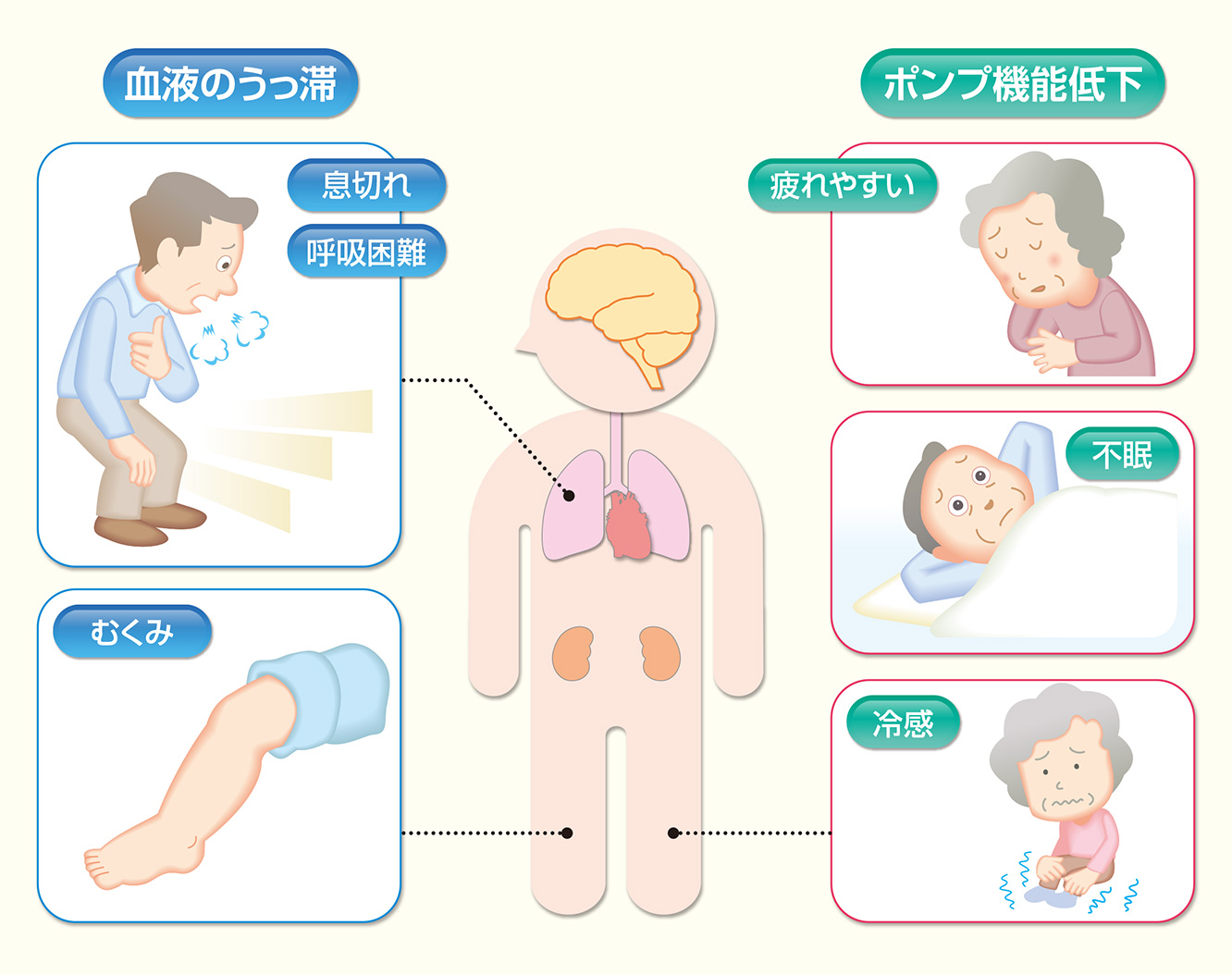
心不全の症状には、収縮機能の低下しポンプで血液を全身に送り出すことができなくなって全身の臓器に十分な血液が行き渡らないことから筋力が低下し疲労感、脱力感、不眠、冷感(頬、耳たぶ、手足の指先が冷たく)などが起こります。また、尿量が減ったり、心不全の初期には夜間の頻尿が認められることがあります。また、拡張機能が低下し全身の血液が心臓に戻れなくなって血液がうっ滞することによって息切れ、呼吸困難、むくみ(浮腫)などが起こります。最初のうちは、階段や坂道などを登ったときに息切れする程度ですが、進行すると、少し歩いたり身体を動かしたりするだけでも息苦しくなります。そして、もっと悪化すると、安静にしていても症状が出るようになり、夜中、寝ているときでも咳が出たり、息苦しさで寝られなくなることもあります。そうした場合、イスに腰掛けるなどの姿勢をとると呼吸が楽になります。これを起坐呼吸と呼んでいます。むくみ(浮腫)は下肢によくみられ、むこうずねの下あたりを強く抑えると指のあとが残ります。また、頸静脈の怒張を認めます。むくみがあるとその分体重が増加しますので、短期間で体重が増加する場合は要注意です。腸管などがむくむと食欲不振の原因になります。
急性心不全の分類
心不全をカテーテルを用いた血行動態からみる方法、身体所見から得られるリスク層別化の方法、急性期の初期対応のために血圧を軸とした方法の3つの分類があります。
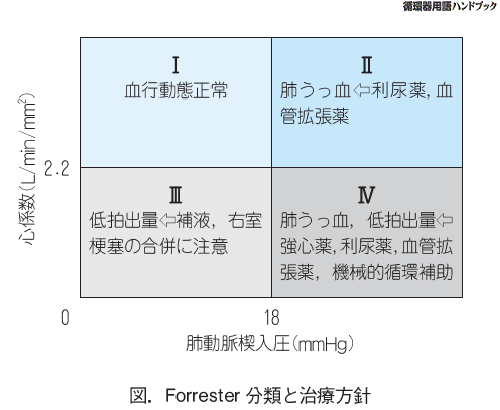
(1)Forrester分類(フォレスター分類)は右心カテーテル検査で得られる血行動態指標(肺毛細血管楔入圧、心係数)を用いたもので、急性心筋梗塞に伴う急性心不全の予後分類であり、梗塞による急激な左心機能の低下に基づく心不全という前提がある(すなわち右 心機能は保たれていること、循環血液量は一定であることが前提でなので、慢性心不全の急性増悪の評価はできません)入院に侵襲的な検査による評価なので詳細は清書を参照して下さい。
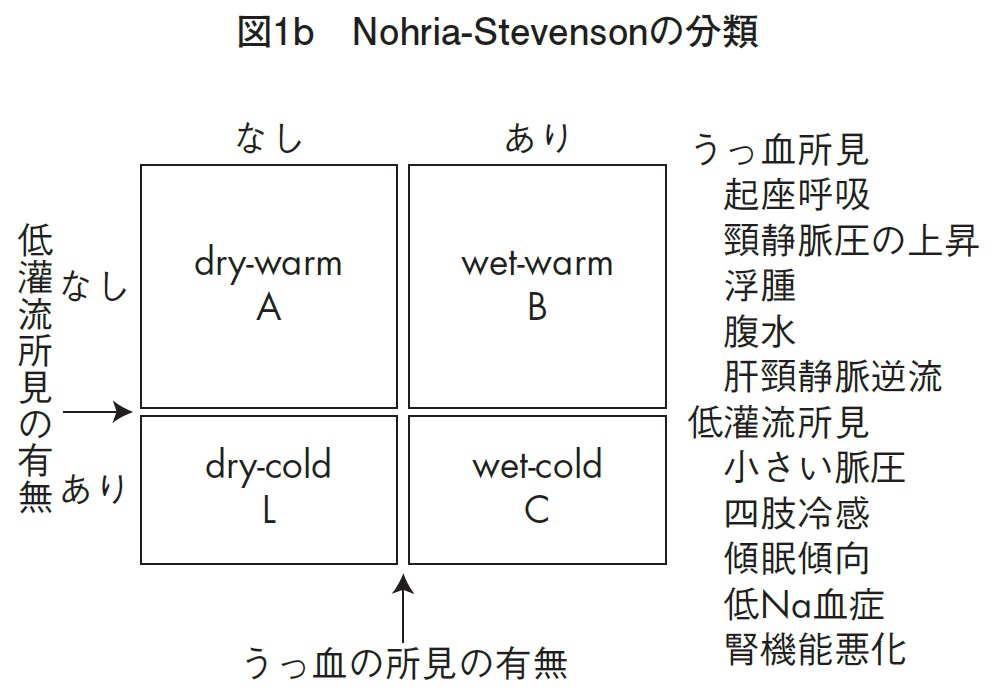
(2)Nohria-Stevenson分類(ノリア・スティーブンソン分類)は、身体所見から得られる低灌流所見およびうっ血所見から心不全患者のリスク層別化をする分類です。簡易で、非観血的に評価できます。うっ血所見は、起座呼吸、頸静脈圧の上昇、浮腫、腹水、肝頸静脈逆流のありなしでwetかdryに分け、低灌流所見は、小さい脈圧((収縮期血圧-拡張期血圧)/収縮期血圧<25%)四肢冷感、傾眠、低Na血症、腎機能悪化のありなしで、warmかcoldに分けられる。Warm & dryのProfile Aは、Forrester分類のⅠ型に相当する症例が多く、重症度は低い。心拍出量が保たれているB型では左心機能不全が主体。C型では心拍出量が低下しており右心不全症状が全面に現れる。短期間での心臓移植を含む死亡例はProfile CとBに多い。Cold & dryのProfile Lには右心不全症例も含まれます。この分類は、臨床所見がきちんととれるかなり高いスキルが必要です。
A:dryーwarm うっ血や低灌流所見なし
B:wet-warm うっ血所見はあるが、低灌流所見なし
C:wet-cold うっ血および低灌流所見を認める
D:dry-cold 低灌流所見を認めるが、うっ血所見なし
(3)クリニカルシナリオ(clinical scenario; CS)分類は循環器専門医以外の医師が救急外来での初期対応導入を迅速に行えるように作られた分類です。急性心不全を発症した時に収縮機血圧が高い人は予後が良いという知見から、初診時の収縮機血圧を指標としており、非侵襲的かつ短時間で測定が可能であるため、利便性が非常に高い。収縮期血圧を参考にその病態を把握して速やかに治療を開始するアプローチ法として臨床現場で広まっているが、注意点として、血圧値のみで治療方針を決定しないこと。CS4は心筋梗塞など急性冠症候群がある場合なので、なるべく早くカテーテル治療をしなければなりません。CS5は右心不全などが含まれます。
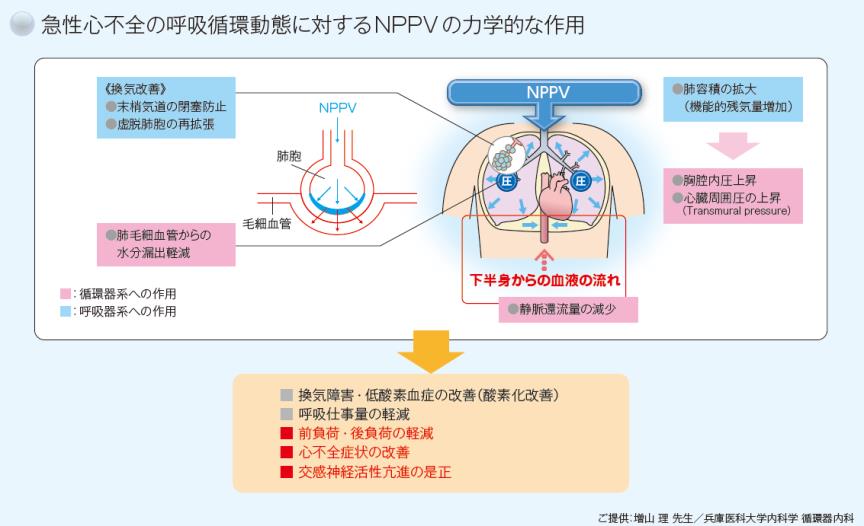
NPPV(非侵襲的陽圧換気)の主な積極的適応は、うっ血性心不全やCOPD等によるⅡ型呼吸不全です。うっ血性心不全は酸素全開投与でも呼吸困難感が改善しない場合、Ⅱ型呼吸不全であれば、ベンチュリーマスクでも低酸素や二酸化炭素貯留が改善しない場合に使用します。心不全の場合は、肺胞も膨らむし、静脈還流の前負荷が軽減するため、非常に素早く色んな事が改善します。しかし、非協力的な場合や肺炎の合併、血管内脱水があるような場合など実際の現場では適応が難しい症例もあるのが現状です。
検査
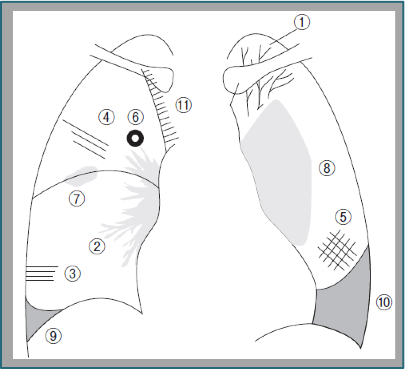
(1)胸部レントゲン
①cephalization(角出し像)
②perivascular cuffing(肺血管周囲の肥厚)
③Kerley’s B
④Kerley’s A
⑤Kerley’s C
⑥peribronchial cuffing(気管周囲の浮腫)
⑦vanishing tumor(一過性腫瘤状陰影)
⑧butterflay shadow
⑨⑩costophrenic angle(肋骨横隔膜角)の 鈍化
⑪上大静脈の突出
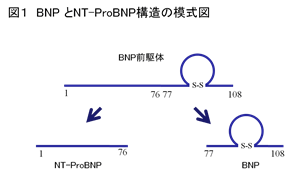
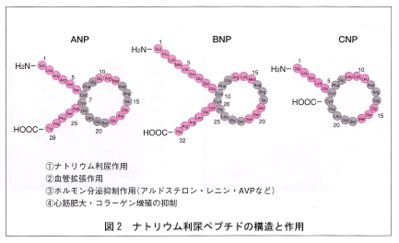
(2)BNP:brain natriuretic peptide(脳性ナトリウム利尿ペプチド)
ナトリウム利尿ペプチドの一つです。最初ブタの脳から精製されたことから「脳性」という名前が付きましたが、ヒトでは心臓の心室から分泌される心血管ホルモンとして機能しています。BNPもANPも日本人が発見しました。BNPとは心臓(おもに心室)から分泌されるホルモンで、利尿作用、血管拡張作用、交感神経抑制、心肥大抑制などの作用があり、心筋を保護するように働きます。
今まで、心不全(心臓が元気かどうか)を簡便に調べる検査がありませんでした。BNPは心臓に負荷が増えたり心筋の肥大がおこると増加するので、採血で血液中の濃度を調べることで、心臓に負担がかかっているかどうかをスクリーニングできる極めて画期的な血液検査です。BNPは主に心筋細胞にて産生、分泌されます。前駆体ホルモンであるproBNPが蛋白分解酵素により生理活性を有するBNPと生理活性のないNTproBNPに分解され、血中に放出されます。元来は生理活性を有するBNPの測定系が開発され臨床応用されましたが、近年では、特殊なスピッツ(血中における安定性はBNPより良好で、検体として血清を使用できます)の必要がない非生理活性型のNTproBNPの測定系も普及してきました。
BNPは血管拡張作用やNa利尿などの生理活性を有し半減期が20分と短くすぐに代謝されるため常に心臓における産生にフィードバックをかけて、刻々と変動する心臓の状態をより反映している可能性はあります。一方、NTproBNPは半減期が120分と長く代謝は腎臓のみと考えられており、半減期が長い分より血中濃度が高くなります。両者においてその優越性に関する結論はでていません。
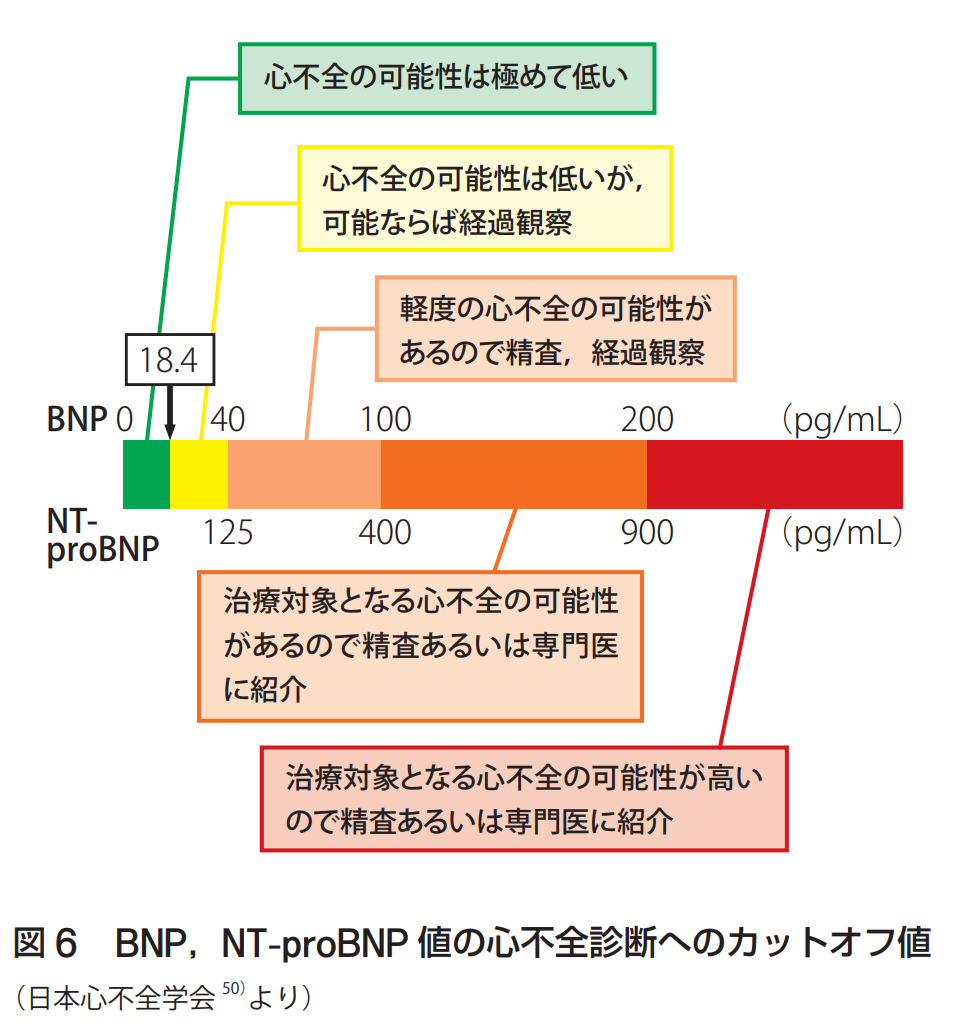
心不全の診断におけるBNP、NTproBNP測定の意義はほぼ確定しています。BNPは自覚症状が出る前から血中濃度が上昇することが証明されていますので、心機能低下の早期発見にも有用であると考えられます。BNP値が18.4〜40pg/mlの場合は心不全の危険因子を有している症例でも直ちに治療が必要となる心不全の可能性は低いと判断されます。ただし、BNPだけでは心不全の程度を過小評価してしまう場合(収縮性心膜炎、僧帽弁狭窄症、発作的に生じる不整脈、一部の虚血性心疾患、高度肥満などを伴う心不全)もあるので、症状や症候を十分に加味して判断して下さい。BNPが100以下では心不全の可能性が低くなり、100以上では高くなります。病歴、既往歴、身体所見から、呼吸困難の原因は喘息と思っていたのに、BNPが400以上だった場合は、心臓喘息かもしれません。BNPが異常高値を認めた場合、何らかの原因(慢性心不全、急性心不全、心筋症、心肥大)で心室が楽に動けない状態になった時に、心筋が他の臓器などに苦労を知らせるホルモンで、いわば心臓の悲鳴の程度を表すものです。呼吸困難を主訴に来院した検討では、BNPのカットオフ値を100pg/ml(NTproBNP400pg/ml)とすると心不全診断の感度は90%、特異度76%と報告されています。BNP100pg/ml(NTproBNP>400pg/ml)であれば、治療対症となる心不全の可能性があるので精査あるいは専門医療機関へ紹介を検討する必要があります。
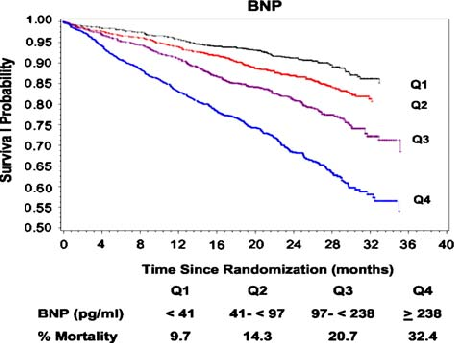
BNPは多くの臨床研究で心不全の予後予測にも有用とされています。中等度から重症の心不全患者を対象としたバルサルタンの有用性を検討したVal-HeFT試験のサブ解析では、BNP値を4群に分け、BNP値が高いほど死亡率が高いことが報告されています。慢性心不全の診断が確定している患者においてBNPを経時的に測定しBNPを指標にして心不全治療薬を増量したり、悪化をより早期にとらえやすいなどの有用性は報告されていますが、BNP値をある数値以下に下げたほうがいいという目標値などはありません。実際の臨床では、過去のBNP値と比較して、身体所見、その他の検査を組み合わせることでその患者さんの最適値を見つけて、維持するよう包括的な治療を行うことが大切と思われます。
実際の慢性心不全の臨床では、NT-proBNP測定値(pg/mL)が1000を越える場合もたくさんあります。NYHA分類ではNYHAⅠ度がNT-proBNP500程度、Ⅱ度が3000前後、Ⅲ度が5000前後、Ⅳ度8000以上、とおおまかに予測されます。以下、簡易的な目安です。
55以下:心血管系に問題なし
55-125:高血圧などを含む生活習慣病の疑い(早期の予防・改善を)
125-500:生活習慣病and/or心不全を含む心臓病の疑い(早期予防改善に加え、経過観察が必要)
500-1000:心不全を含む心臓病の疑い(心機能のチェックを行い、適切な治療が必要)
1000-4000:心不全を含む心臓病の疑い(専門医への紹介が必要)
4000-8000:心不全を含む心臓病(早期専門医紹介、精査治療が必要)
8000以上:心不全を含む重篤な心臓病(緊急の入院、加療が必要)
(3)心エコー
40-100pg/mlの場合には、軽度の心不全の可能性があります。危険要因が多い症例や心不全を発症する基礎疾患を持っている症例では、胸部X線、心電図、心エコー図検査の実施をお勧めします。心不全は、軽度な場合は、心電図や胸部レントゲンなどではファジーにしかわかりません。心臓がちゃんと動いているかは、循環器の専門医療機関を受診し、心エコー検査で、心臓の収縮力を表す、EF(駆出率)という指標が汎用されていました。絶えず働いている心臓の動きを実際にリアルタイムでみることができる検査です。心臓が弱ってくると、心臓のサイズが大きくなることが多く、心臓の形もしだいにボールのように丸くなってくることも知られています。また、心臓の壁の厚さを調べることで、心肥大があるかどうかもわかります。心臓の動き方が調べられるのも大切な点で、心筋梗塞の場合は梗塞が起こり、収縮運動をしない心筋の場所や範囲がわかりますし、さらに心臓全体の機能の良しあしも左室駆出率という数字で客観的に評価することができます。
「急性及び慢性心不全の診断と治療ガイドライン2016」の改訂版では、従来から大きく二分されていた左室駆出率(LVEF)が低下した心不全(heart failure with reduced EF:HFrEFヘフレフ)とLVEFが保持された心不全(heart failure with preserved EF:HFpEFヘフペフ)との間に、LVEFが「mid-range」の心不全(heart failure with mid-range EF:HFmrEFミッドレンジ)が新たに加わりました。LVEF<40%がHFrEF、LVEF40-49%がHFmrEF、LVEF≧ 50%がHFpEFということになるが、BNP(B型ナトリウム利尿ペプチド)>35pg/mLおよび/またはNT-proBNP>125pg/mLがHFrEF以外の診断基準に明記されることにもなりました。
へふぺふ HFpEF(heart failure with preserved ejection function)「収縮機能が保たれた心不全」
心臓には、血液を循環させるための二つの機能があります。全身へ血液を送り出すための「収縮機能」と、全身から戻ってきた血液を取り込むための「拡張機能」です。以前は、左心室の収縮力が低下し(左室駆出率が40%未満)左心室が拡大した「収縮機能不全」が心不全の主な原因と考えられていました。しかし、最近の研究から、高齢者の心不全の半数は、収縮力が保たれているにもかかわらず、左心室が硬くて広がりにくいために、心不全症状を呈する「拡張機能不全」というタイプの心不全であることが分かってきました。簡単にいえば、心臓へ血液が戻る力が弱くなっているため、うっ血が起こり、むくみなどの症状が起こりやすいといった特徴があります。実際には、拡張能を正確に評価することが難しいため、「収縮機能が保たれた心不全」(heart failure with preserved ejection function: HFpEF)と呼ばれています。
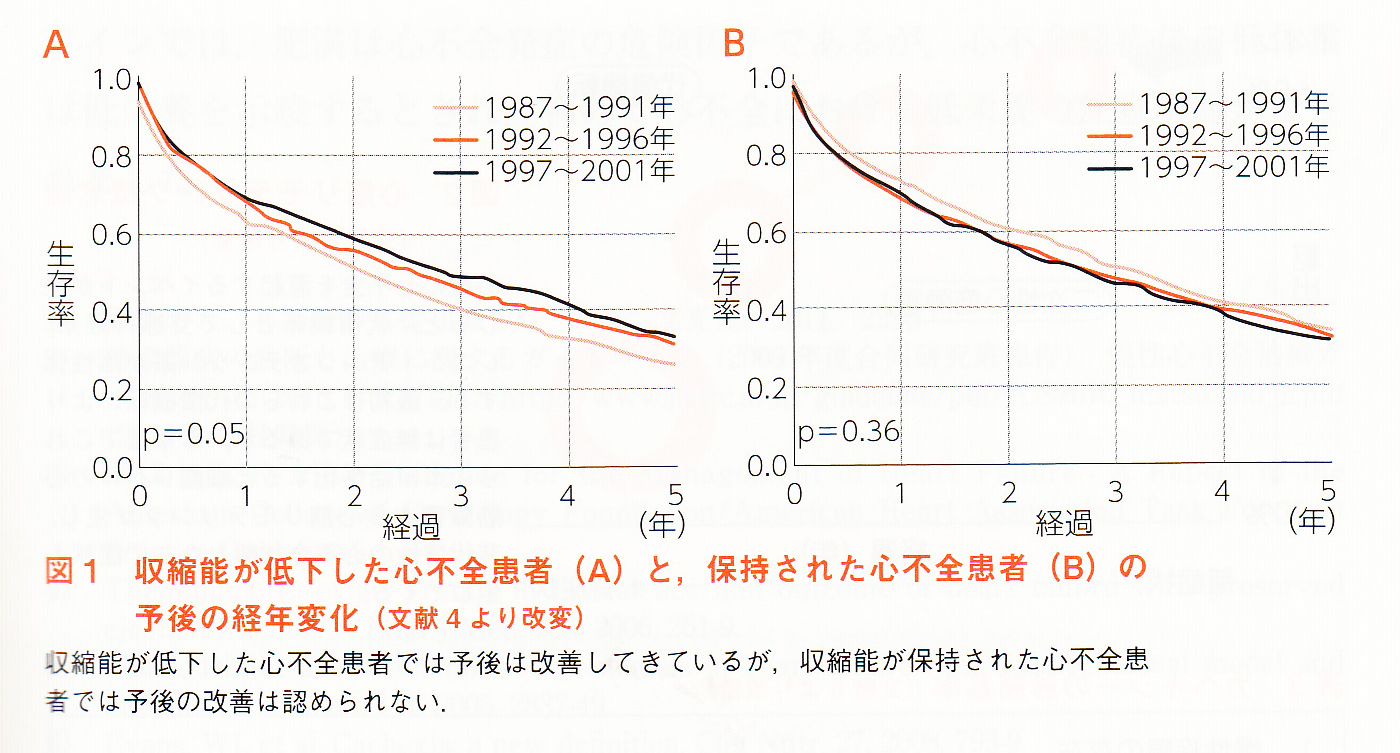
拡張不全は、収縮機能は保たれているため症状が出にくいのが特徴です。収縮不全の場合、胸部X線で心陰影が大きくなっているなどの所見が認められますが、拡張不全では、収縮機能が正常に保たれているためこうした所見がはっきりしないことも多いのです。確定診断には、心エコー検査のほか、血液検査のBNPが決め手になります。(収縮機能の低下した心不全(HFrEF)の方がBNPは高値)HFpEFの特徴は、高齢者、女性に多く、高血圧症、糖尿病、肥満、心房細動など心臓の病気などの基礎疾患を持っている人、とくに身体活動度の低い人に多いため、症状に気づきにくく、放置してしまうケースも少なくありません。(虚血性心疾患は、収縮機能の低下した心不全(HFrEF)の方が多い)また、収縮機能の保たれているにもかかわらず、収縮機能が保持された心不全(HFpEF)では、経年的にも予後の改善はされていないことが疫学調査などから明らかになっています。
治療についても収縮機能の保たれた心不全(HFpEF)は、収縮機能の低下した心不全(HFrEF)には有効とされる治療薬(ACEやβブロッカーなど)が無効なため、予後を改善する治療法はなく、原疾患の治療、併存疾患の治療に加え、利尿剤等でうっ血を軽減するなど症状の改善を目的とした対症療法しかできていないため、予後改善より、QOL改善を目指す治療を行うことが現状です。
慢性心不全
さて、急性心不全の病態は入院後せいぜい1〜2週間程度でほとんどが良くなっていきます。急性心不全を脱して良くなった患者さんは、すべて慢性心不全患者ということになります。
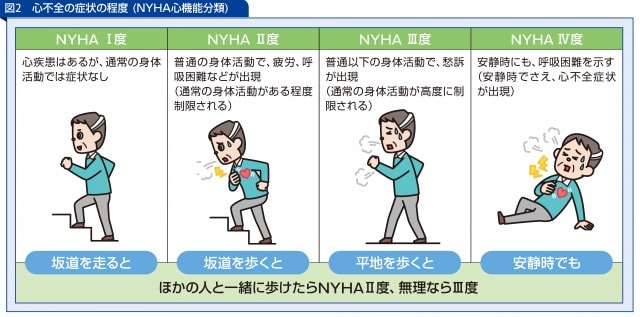
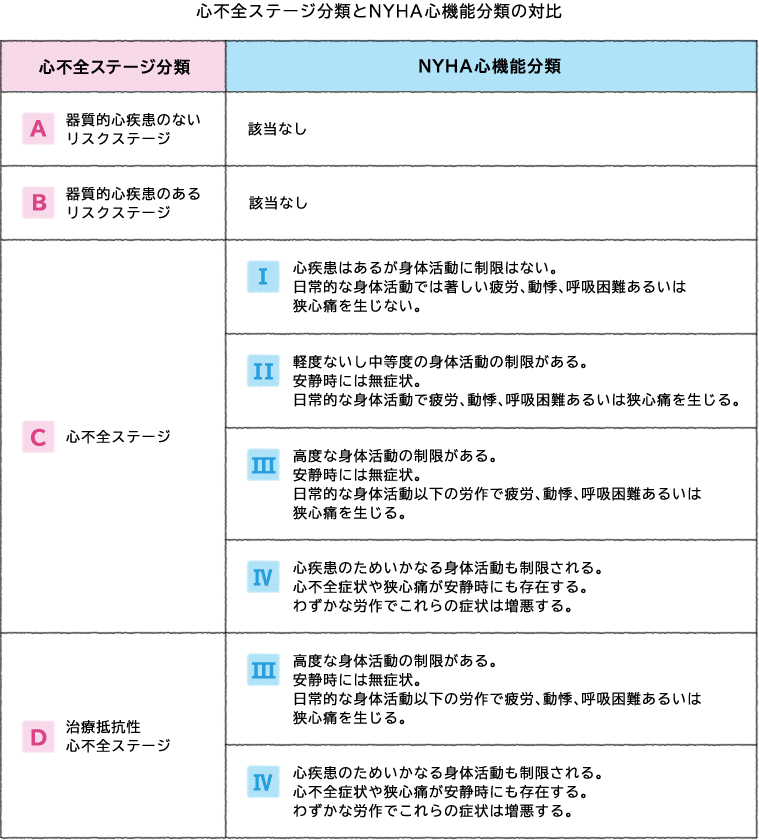
慢性心不全の重症度分類はニューヨーク心臓病協会(NYHA:New York Heart Association)のものがよく使われています。心機能の程度を問診所見(自覚症状)つまり患者さん自身がどう感じているかによってから分類します。以下のように心不全における身体機能の重症度を4段階に分類しています。
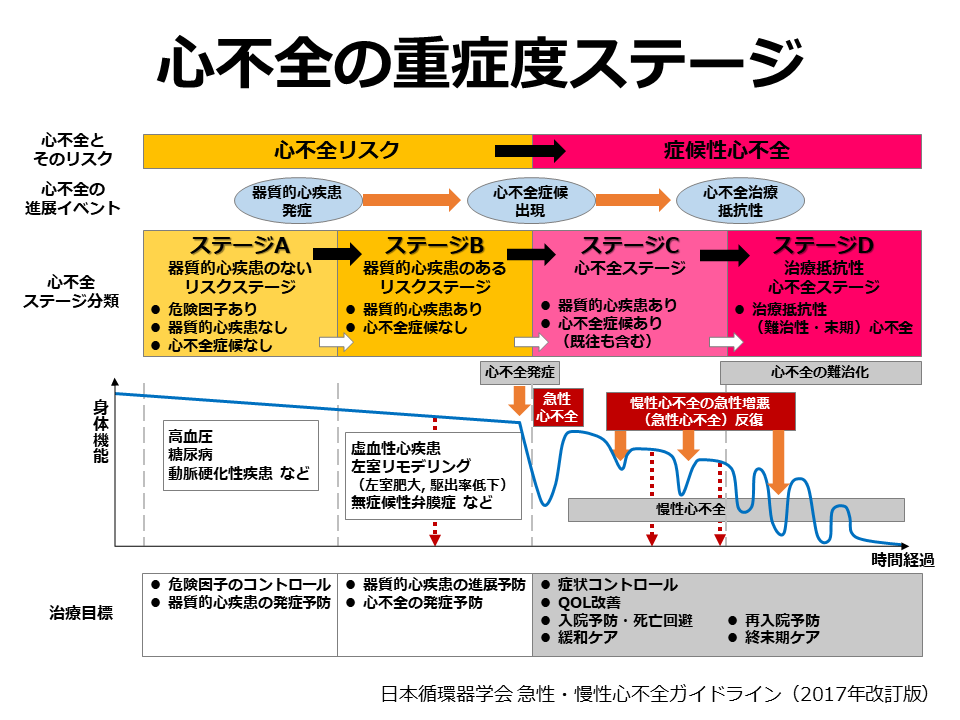
今でもNYHA心機能分類は、その簡便性、日常生活でも運動耐容能を示す指標として重要性は変わりありませんが、最近では、心不全の病期の進行については 2001年にACC/AHA(American Heart Association / American College of Cardiology)の心不全に関するガイドラインから登場した心不全ステージ分類が用いられることが多くなりました。このステー ジ分類は適切な治療介入を行うことを目的にされており、無症候であっても早期に治療介入することが推奨されています。
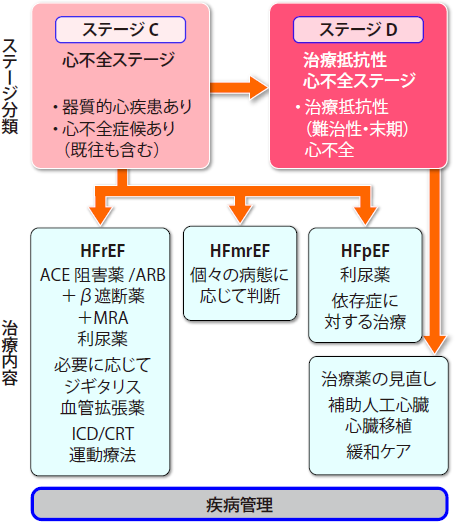
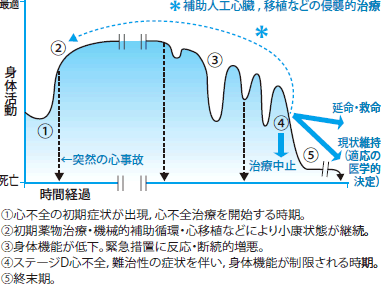
縦軸に「心不全とそのリスク」「心不全の進展イベント」「心不全ステージ分類」「身体機能」「治療目標」の各項目が並び、それぞれがどのように進展していくかがひと目で分かるように示されています。心不全がステージAからB、Cと経てDへと不可逆的に身体機能が低下する様子が視覚的に理解できるよう示されています。心不全未発症段階のステージA・Bをあえて入れることで、心不全は進行性であることと治療に関しても予防的なアプローチの重要性が示されており、ステージAにおける高血圧や糖尿病などのリスクファクターの管理、ステージBにおける器質的心疾患の進展予防による心不全の発症予防などが強調されています。足に浮腫があって胸部Xpでうっ血が認められてゼイゼイ言っているなんて患者さんは誰が診てもおかしいわけですが、ほとんどの患者さんはNYHA分類Ⅱ度ぐらいが多くて全く症状のないNYHA分類Ⅰ度に行ったり来たりするわけですからこの軽い動作で息切れが果たして心不全?かどうか心疾患があることが条件と言われても高血圧があったとしてちょっと心肥大があったら?としてもこれが心不全によるものかを診断すること自体が難しいわけです。つまり、これらも含めてさっさと治療を介入しましょうというのが心不全ステージ分類です。各ステージの定義については、リスク因子をもつが器質的な心疾患がなく、心不全症候のない患者をステージA、器質的心疾患を有するが、心不全症候のない患者をステージB、器質的心疾患を有し、心不全症候を有する患者を既往も含めてステージCとなる。さらにおおよそ年間2回以上の心不全入院を繰り返し、有効性が確立しているすべての薬物治療・非薬物治療について治療ないしは治療が考慮されたにもかかわらずNYHA分類III度より改善しない患者はステージDと定義される。これらの患者は補助人工心臓や心臓移植などを含む特別の治療もしくは終末期ケアが適応になるとしています。
またNYHA心機能分類は日常生活動作における自覚症状の有無や程度で分類するため、治療により自覚症状が軽快することで段階が戻ることがよくありますが、AHA/ACC心不全ステージ分類は基本的にステージの進行は不可逆的であるとされており、患者さんは治療により症状が軽快しても病期は確実に進行してステージが決してもとに戻ることはありません。ステージCになると治療により症状が軽くなり、無症状になる場合もあるものの、ステージBには戻らないとしています。心不全ステージ分類と NYHA分類の対比を示します。
診断基準
フラミンガム基準とは、心不全という症候群の客観的な基準をつくった唯一の研究で、現在でも心不全の診断の際に広く用いられている。(心不全は病気の名前ではなくあくまで症候群。)心不全の原因として虚血性心疾患、高血圧、弁膜症、心筋症などがある。大症状2つか,大症状1つおよび小症状2つ以上を心不全とする。例えば、胸部Xpで心拡大と肺水腫を認めたら心不全と診断できる。

治療
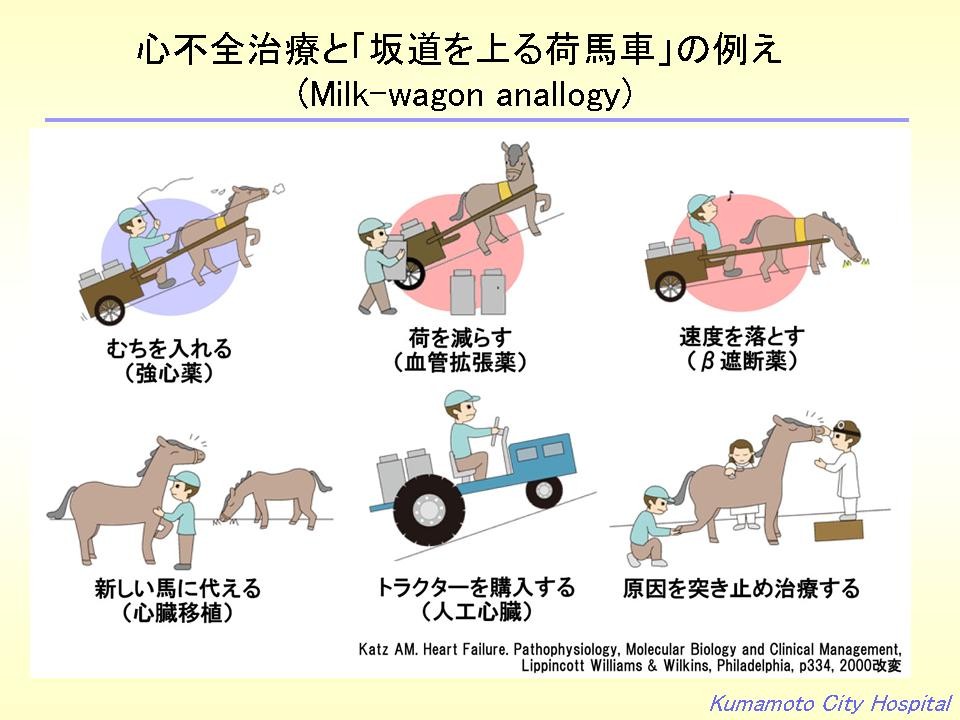
心不全の治療に説明によく用いられる「坂道を上がる荷馬車」の例えから説明すると強心剤は馬にむちを入れる治療で、急性心不全にへばった心臓を立ち上がらせるために使用されますが、長期的には良くないことがわかっています。血管拡張薬は荷物を減らす治療で、β遮断薬はスピードを緩めてゆっくり休みながら上る治療で、長期予後をよくすることが証明されています。新しい馬に代えるのが心臓移植、トラクターを購入するのは人工心臓というわけです。原因を突き止めて治療するというのは、もっとも理にかなった治療で、例えば、虚血が原因ならば、細くなった血管を広げて十分な血流を確保してあげたり、弁が壊れて狭くなったり、逆流がひどければ新しい弁に交換する手術をしたり、心房細動や発作性上室性頻拍、心室頻拍など不整脈が原因の場合は、アブレーション治療などで不整脈が起こらなくしてあげるといいわけです。
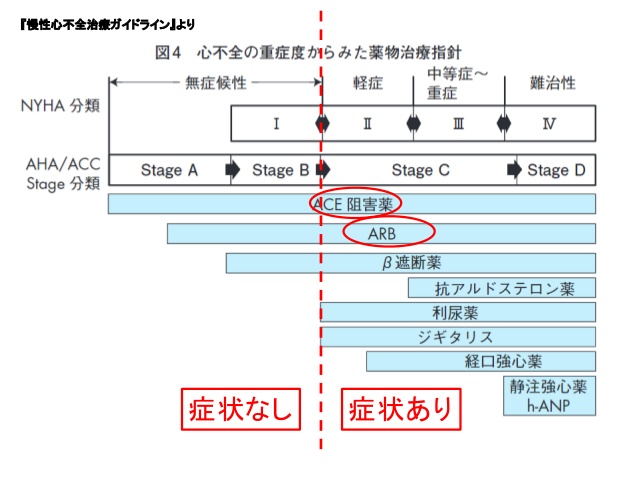
慢性心不全(収縮不全)の治療を理解するには、Stage分類が便利です。Stage Aは、心不全になる前の前の段階です。高血圧や糖尿病などリスクを持っているという段階なので予備軍です。このStageではACE(ARB)阻害薬(予後の改善)を用います。Stage Bもまだ心不全ではありません。NYHA Iの段階で、心臓にが悪い(心筋梗塞や高血圧性心肥大など)けれど、息苦しいなどの症状なく、β遮断薬(予後の改善)の適応です。Stage Cになって、むくみなどが出てきた時点で心不全です。軽症はNYHA IIから中等症〜重症のNYHAⅢの段階で、利尿薬(QOLの改善)抗アルドステロン剤(予後の改善)の3剤が心不全の基本となります。これでも良くならないStage Dの段階では、使いたくはないけれど仕方なく強心薬を使用します。
ACE阻害薬、ARB
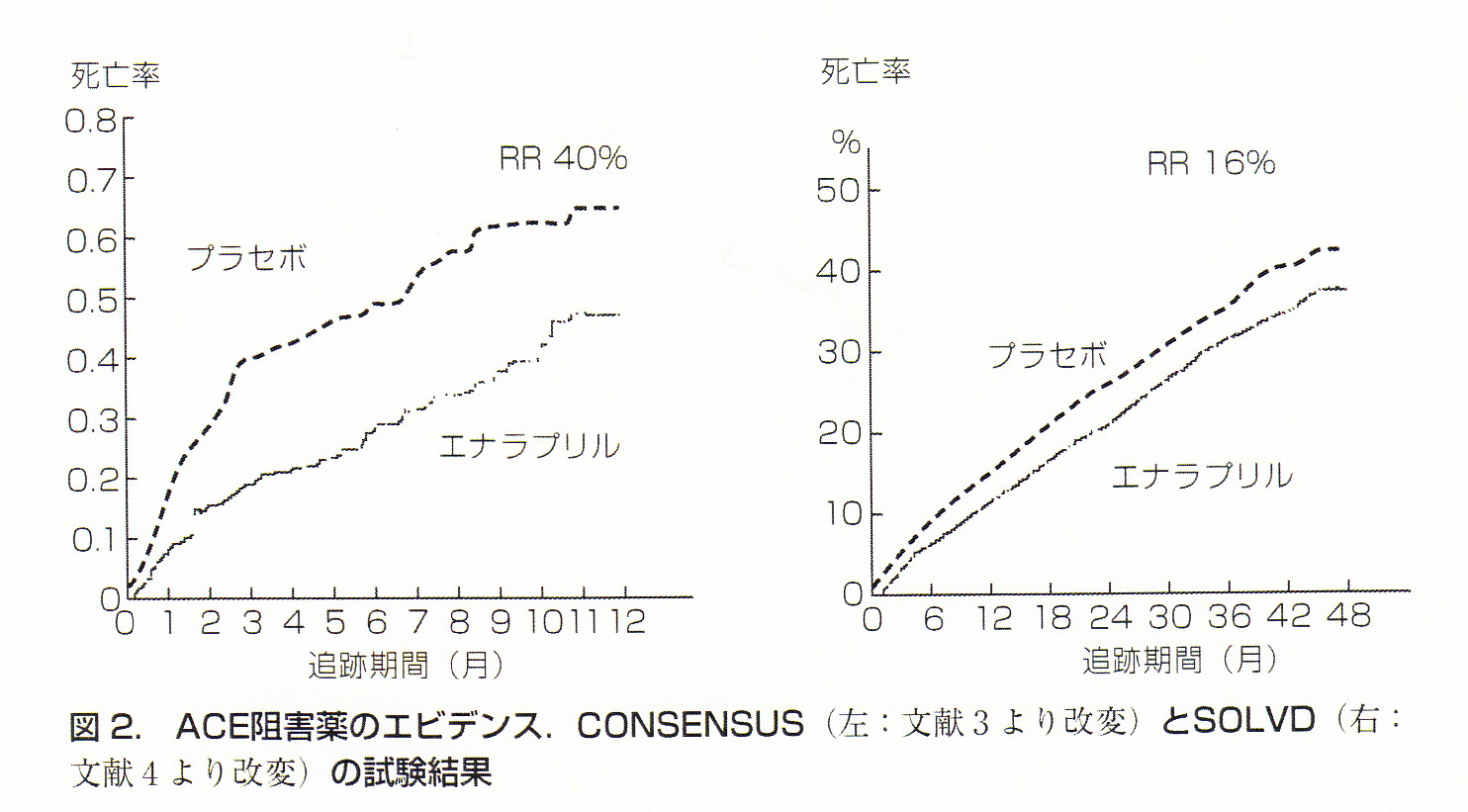
1987 年のCONSENSUS試験はACE阻害薬であるエナラプリルの重症心不全に対する予後改善効果を示しパラダイムシフトをもたらした臨床試験です。この試験にはNYHA IV度に相当する患者がエントリーされておりプラセボ群の1年死亡率が52%という非常に重症な心不全においてエナラプリルが極めて有効性が高いことが示されました。また1991年のSOLVD試験においてより軽症のNYHA II~III度の患者群でも引き続き、有効性が示されました。心不全におけるレニンアンジオテンシン(RA)系の活性化が悪循環をもたらしそれを断ち切ることがACE阻害薬の予後改善効果の根幹であるとされています。ACE阻害薬の有効性はエナラプリルとリシノプリル以外の薬剤に明確なデー タはないがなんとなくクラスエフェクトとされているのが現状であるが、我が国における慢性心不全に対する保険適応はこの2剤のみです。
ARBは、ACEに依存しないAIIの産生経路があること、ACE阻害薬の投与によりブラジキニンの産生が増加するため空咳が特に我が国の女性に多いことなどはACE阻害薬に不利な点と考えられており、ARBはこれらの点を一挙に解決できる可能性があると考えられていたが、2000年前後に発表された対ACE阻害薬の試験であるElite II、RESOLVD、OPTIMAALなどではARBの有効性はすべて同等以下であり、残念なことにACE阻害薬を凌駕する成績は出せませんでした。でもACE阻害薬に忍容性の低い患者における切り替えが適切とされており、我が国における慢性心不全に対する保険適応はカンデサルタンのみとなっています。
β遮断薬
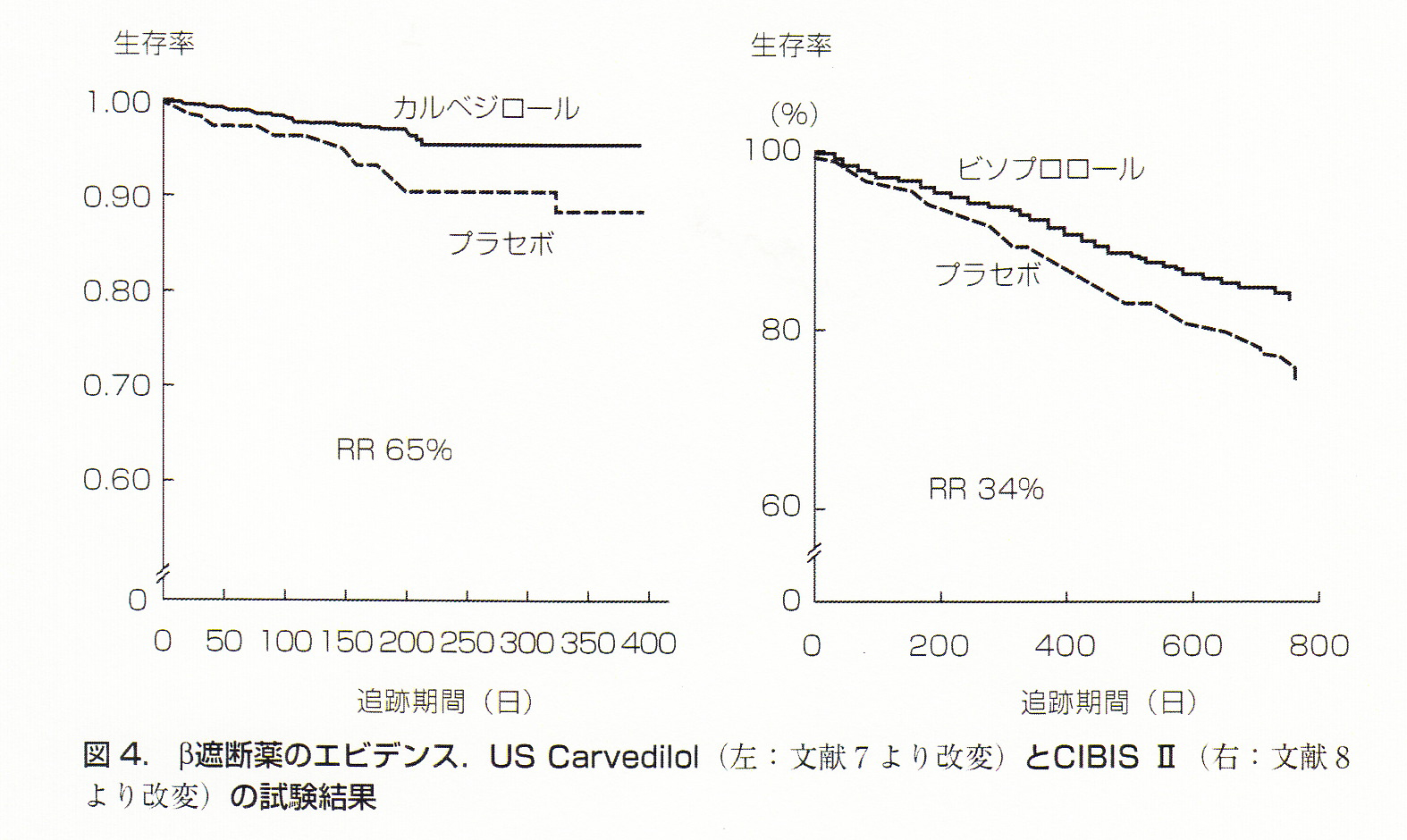
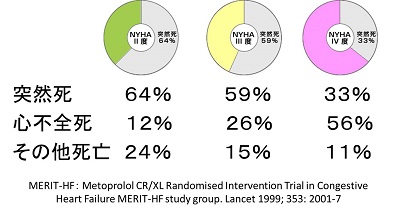
心不全治療に対し保険適応下で使用できるβ遮断薬は現在2種類あります。カルベジロールとビソプロロールです。大規模試験として検証されたのは1996 年US Carvedilol 試験が最初です。NYHA II~III度の収 縮不全患者に対してカルベジロールは非常に高い有効性を示したのみならず、そのサブ解析であるMOCHA試験において用量依存性に特に非虚血性心不全においてEFの改善が認められることを示しました。予後を改善させることが証明されて いるACE阻害薬やアルドステロン拮抗薬による EFの改善効果というものは認められていません。1999 年にはビソプロロールとメトプロロールもCIBIS IIと MERIT-HF試験においてNYHA II~III度の収縮 不全患者群に対して有効性が証明されています。CIBIS-IIの対象はNYHAIII-IV, LVEF≦35%の慢性心不全患者2647例。ビソプロロールは1.25mg/日より開始され忍容性に問題なければ2.5mg, 3.75mg, 5mg, 10mg/日へ増量されました。ビソプロロール群、プラセボ群それぞれ推定年間死亡率は8.8%、13.2%であり、プラセボ群と比較したビソプロロール群における総死亡リスク低下率は34%でした。カルベジロールはNYHA I度やIV度の患者に対しても CAPRICORN試験やCOPERNICUS試験で有効性を確立しており、NYHA I度から適応とされています。MERIT-HFのコハク酸メトプロロールは我が国 では販売されておらず,酒石酸メトプロロールである。この酒石酸メトプロロールを使用してカルベジロールとの比較を行ったCOMET試験ではカルベジロールが有意に予後を改善す るという結果であったので、少なくとも酒石酸メトプロロールを積極的に使用する必要はないと思われれます。用量については、少なくとも忍容性がある限りは増量すべきであると思われます。
抗アルドステロン薬
心不全では心拍出量と血圧低下に対する生体の代償機序が働いて、腎血流低下によりレニン・アンジオテンシン・アルドステロン系(RAAS)が、動脈受容体を介して交感神経系活性が著しく亢進します。RAASや交感神経系に代表される神経内分泌系因子が過剰に、また長期に活性化されると、心血管系では肥大や線維化などのリモデリングが助長されて、動脈硬化や組織線維化を急速に進展させ各種臓器障害を起こし、病態悪化の連鎖が始まることになります。また、RAASには血中を循環する循環系と組織内局所での作用を発現する組織系のものが考えられており、心肥大や血管肥厚、動脈硬化といった局所の構造的変化(リモデリング)に関与する慢性の調節系であると考えられています。アンジオテンシン変換酵素(ACE)阻害薬は、アンジオテンシンIからアンジオテンシンⅡへの変換を阻害することにより、また、アンジオテンシンⅡタイプ1受容体阻害薬(ARB)はアンジオテンシンⅡタイプ1受容体を拮抗してRASSを抑制しますが、ACE阻害薬ではRAASは完全には抑制しきれず、キマーゼを介しアンジオテンシンⅡが産生され、アルドステロンブレークスルーが生じると考えられています。RAAS抑制薬の中で、RASS下流のアルドステロン受容体であるMRを阻害する抗アルドステロン薬には、非選択的なスピロノラクトンと選択的なエプレレノンがあります。
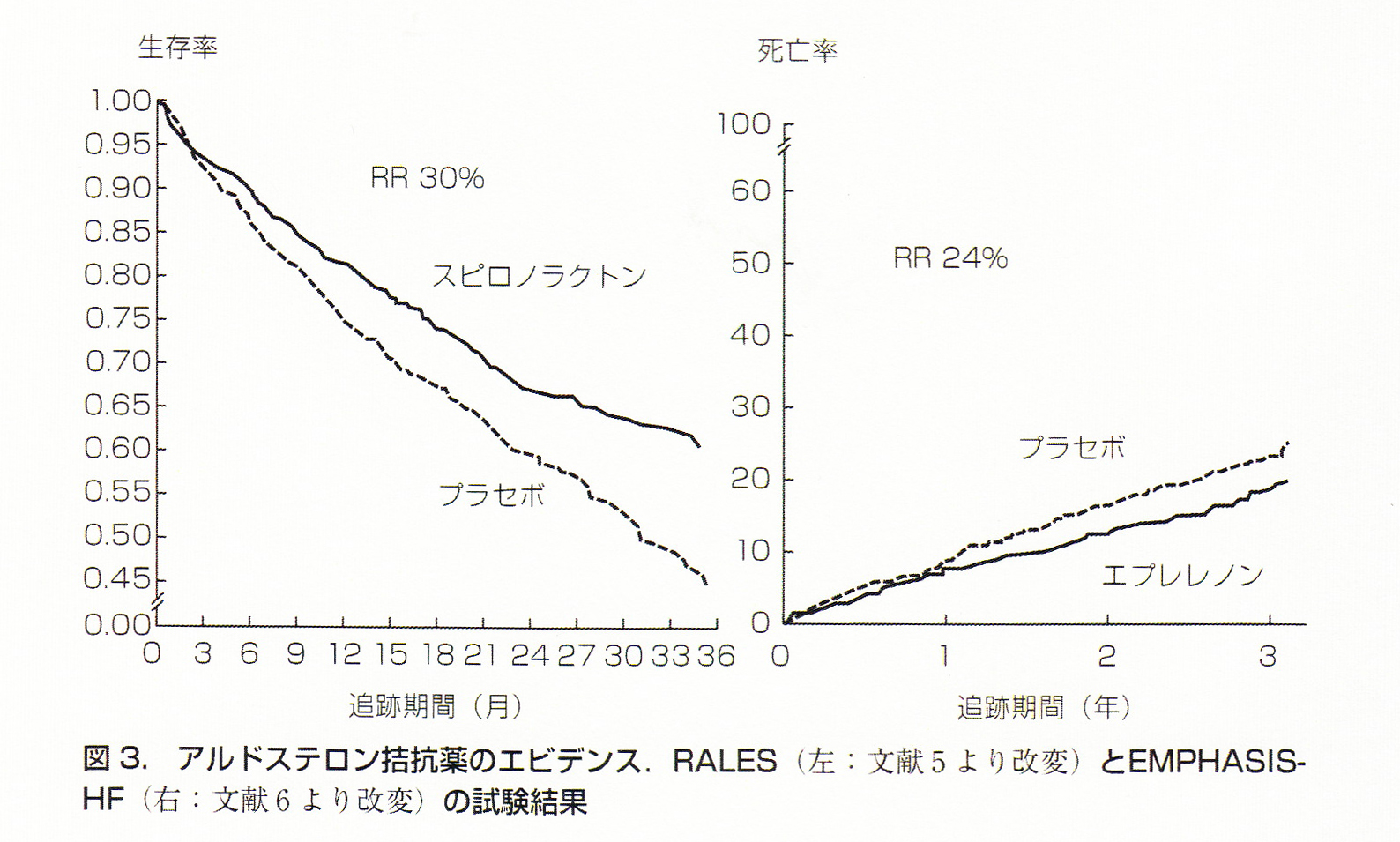
1999年、RALES試験(Randomized Aldactone Evaluation Study)は、NYHAⅢ度以上の重症心不全で標準治療を受けている患者さんに対するスピロノラクトン追加群の効果を検討した無作為割付け、プラセボ対照、二重盲検試験です。左室駆出率35%以下でACE阻害薬、ループ利尿薬、ジゴキシンによる治療を受けている1663症例の患者に対して、スピロノラクトン25mg投与群(822例)においてプラセボ群(841例)に比べて、平均追跡期間24か月の中間解析の時点で、スピロノラクトンの有効性が明らかになり試験は中止となりました。突然死も含めた死亡率は30%減少し、入院の頻度も35%減少しました。同群における死亡リスクの30%低下は、心不全進行による死亡と心臓突然死の低下によるものでした。しかしながら、少なからず、スピロノラクトンには高カリウム血症と女性化乳房の副作用(女性にはスピロノラクトンでまったく支障ない)があり、ACE阻害薬との積極的併用により血清カリウムの上昇に伴う死亡や心不全入院が増加するとの報告もあり常に注意喚起されるところです。また、RALES試験はNYHA分類のClassⅢまたはⅣの心不全患者を対象としており、軽症心不全患者を対象とした臨床試験ではないことから、スピロノラクトンの心不全早期からの使用には注意が必要です。
スピロノラクトンには女性化乳房という副作用が用量依存性に生じる可能性がありました。これはスピロノラクトンのエストロゲン様作用という抗アルドステロン作用以外の部分に由来すると考えられており、選択的抗アルドステロン薬ならば女性化乳房は生じにくいと考えられていました。そのような目的で開発されたエプレレノンは心筋梗塞後の心不全患者への有効性を2003 年にEPHESUS試験で示されました。さらに2009 年にはEMPHASIS-HF試験において原疾患を問わずNYHA II度の収縮不全の患者に対してエプレレノンはほとんどサブグループを問わずすべてのエンドポイントで有効性を証明しました。
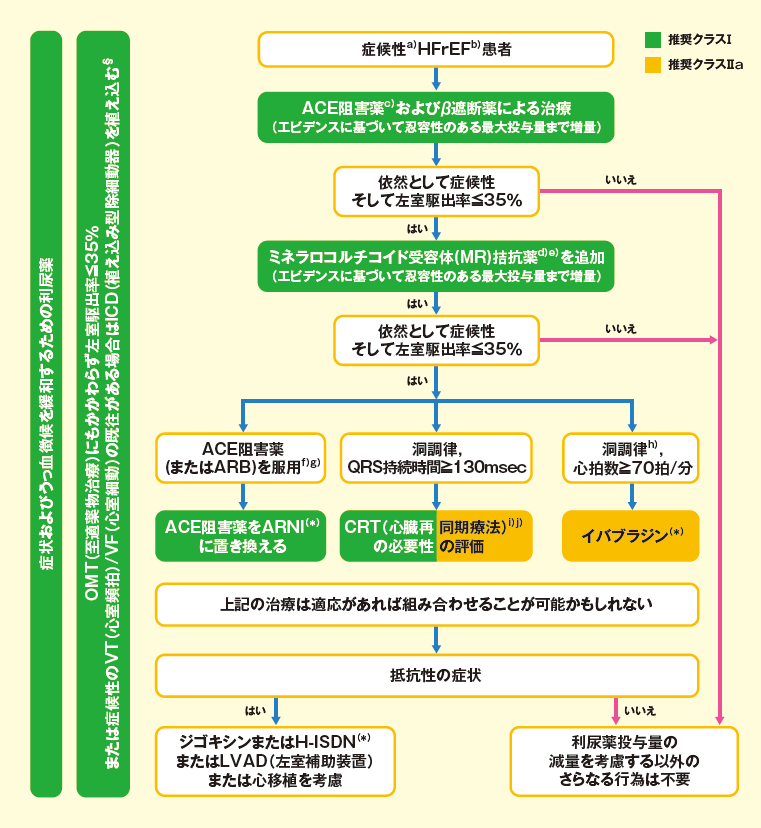
アンジオテンシン受容体-ネプリライシン阻害薬(ARNI)
アンジオテンシン受容体-ネプリライシン阻害薬(ARNI:angiotensin receptor-neprilysin inhibitor)は、レニン-アンジオテンシン系抑制薬とネプリライシン阻害薬との合剤です。ネプリライシンは中性エンドペプチターゼであり、主な作用は内因性血管拡張作用を有するナトリウム利尿ペプチドの分解である。その他、ブラジキニン、アドレノメデュリン、サブスタンスP、アンジオテンシンⅠ・Ⅱ、エンドセリンⅠなどの分解にも関与する。ARNIは交感神経系やレニン-アンジオテンシン系など、血管収縮性に働く神経体液因子に拮抗することにより心不全治療効果を示すと考えられる。
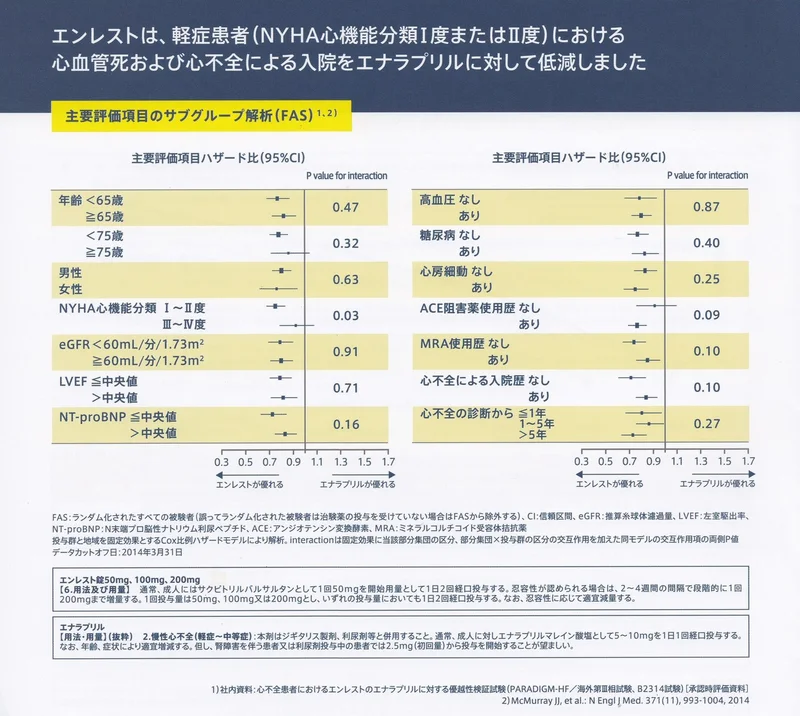
2014年に行われたPARADIGM-HF試験は、NYHAⅡ度以上かつ左室駆出率(LVEF)40%以下(後に35%以下に改訂)の8,442名の心不全患者を対象にした大規模臨床試験で、ARNI投与群はACE阻害薬(ACEi)投与群に比較して、心血管死と心不再入院の複合イベントリスクを20%減少させ、死亡率・心不全再入院も有意に減少させたと報告しています。
イバブラジン
2019年、慢性心不全治療薬イバブラジン塩酸塩(商品名コララン錠2.5mg、同錠5mg、同錠7.5mg)が登場した。適応は「洞調律かつ投与開始時の安静時心拍数が75回/分以上の慢性心不全。ただし、β遮断薬を含む慢性心不全の標準的な治療を受けている患者に限る」、用法用量は「通常、1回2.5mgを1日2回食後投与から開始。その後、忍容性をみながら、目標とする安静時心拍数が維持できるように、必要に応じて2週間以上の間隔で段階的に用量を増減。1回投与量は2.5、5又は7.5mgのいずれかとし、1日2回食後投与。なお、患者の状態により適宜減量」となっている。
イバブラジンは、洞結節にある過分極活性化環状ヌクレオチド依存性(HCN)チャネルを阻害する、新規作用機序の慢性心不全治療薬である。洞結節の自動能形成(ペースメーカー)に寄与する電流は過分極活性化陽イオン電流(If)と呼ばれており、主にHCN4チャネルにより形成される。イバブラジンは、HCN4チャネルを阻害することでIfを抑制し、拡張期脱分極相における活動電位の立ち上がり時間を遅延させる。これにより、心臓の伝導性、収縮性、再分極および血圧に影響することなく、心拍数のみを減少させる。
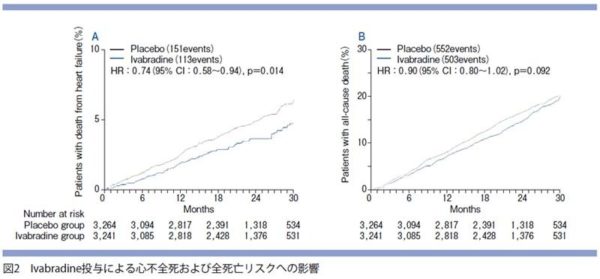
SHIFT試験は、β遮断 薬,RA 系抑制薬,利尿薬が十分に処方されたLVEFが35%以下、NYHA心機能分類がII~IV度、洞調律下での安静時心拍数が70回/分以上の心不全症例に対してイバブラジ ンの追加投与の有効性を検討した試験です。結果 は一次エンドポイントである心血管死,心不全悪化 による入院を 18%も抑制した。しかし,その内訳は 心不全による入院においてのみ有意差が認められ, 心血管死の改善には有意差はなかった。
デバイス治療
デバイス治療には大きく分けて、突然死を予防するための植込み型除細動器(ICD:implantable cardioverter defibrillator)と心不全に対して両心室ぺーシングを行う心室再同期療法(CRT:Cardiac Resynchronization Therapy)の二つの治療法があります。つまり、心不全で亡くなる場合、突然死で亡くなるかもしくは心不全自体の悪化によって亡くなるかのどちらかというわけです。一般的には、心不全が進むと突然死も心不全の悪化でなくなる人も増えるのは当然ですが、心不全の軽い段階では、心不全死より突然死(不整脈死)の割合が多いと考えられます。では、具体的にどういった患者さんにそれぞれのデバイス治療を行うと効果があるのかその適応についてエビデンス的にはどうなっているのでしょうか。
植込み型除細動器(ICD)
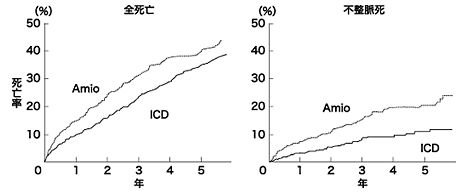
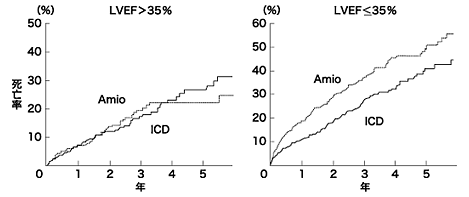
まず、突然死を予防するための植込み型除細動器を考える場合、一次予防と二次予防があります。つまり、VT、Vfから蘇生されたような人に対する植え込み(二次予防)と全くVT、Vfを起こした既往がない人の突然死を予防する(一次予防)は分けて考えなければなりません。最も危険性が高いのは、やはり心肺蘇生例です。VT、Vfから蘇生された人を集めてきて、ICDを入れた人とアミオダロンを投与したした人を比べてみる臨床試験(CASH、AVID、CIDS)が行われました。これらのメタ解析で全死亡と不整脈死でICD群で有意に低値でした。(3年より短い追跡期間では生存期間の延長効果は明らかではない)アミオダロンと比較してICDによる死亡率の抑制率は絶対値として3.5%/年であり29例にICDを植え込むと1年間に1例の死亡を抑制できることになります。また左室機能について層別解析を行うと駆出分画が35%以下の例でICDの効果がアミオダロンに勝り心機能が比較的保たれている例(駆出分画>35%)ではICDの有効性は認められませんでした。VT、Vfを起こす原因は症例によって異なります。虚血性心疾患、電解質異常、心不全の悪化、抗不整脈薬などのバックグラウンドがありますが、いづれの場合も突然死は同様に起こっており、一過性の原因でもそれが確実に除去できるかどうかを個々の症例で検討してICDの適応を考えなければなりません。(例えば、心筋梗塞直後のVT、Vfなどは日本の場合ほとんどPCIによるcomplete revascularizationが行われていれば経過観察でもいいのではないかと思われますし、WPW症候群や特発性心室頻拍などによるVT、Vfはアブレーションが選択されるべきでしょう。また余命短いがん患者や認知症患者は適応とはなりません。ちょっとこくですが、コントロール不可能な頻回に繰り返すVT、VfやNYHA分類Ⅳ度の補助心臓や人工心臓の適応にならない最重症患者もICDの適応から除外されています)
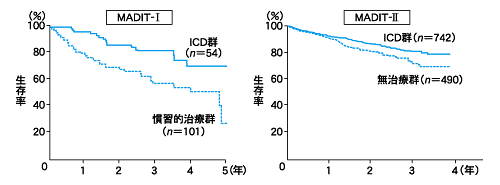
一次予防はどうか、これまでVT、Vfを起こした既往がない人(一次予防)のICD植え込みを考える場合、一次予防の有用性を示したエビデンスとしては、MADIT試験、MADITII試験、SCD-HeFT試験があります。日本のガイドラインでは、冠動脈疾患または拡張型心筋症に基づく慢性心不全で、十分な薬物治療を行ってもNYHAⅡ度Ⅲ度の心不全症状を有しかつ左室駆出率(EF)35%以下で非持続性心室頻拍を有する症例、NYHAⅠ度で冠動脈疾患または拡張型心筋症に基づく左室駆出率(EF)35%以下と非持続性心室頻拍を有し、電気生理学的検査によって持続性心室頻拍、心室細動が誘発される症例となっています。(欧米では拡張型心筋症に対して電気生理学的検査でVT、Vfを誘発することと生命予後の関係は否定されています)
心室再同期療法(CRT)
心不全では、その進行に伴い心電図上のQRS幅は広がり、心室内伝導障害と非協調的心室収縮が生じます。この幅広いQRSの症例は非常に予後が悪いことが以前からわかっていました。非協調的心室収縮を改善する目的で右心房と右心室および冠静脈洞の枝に留置されたリードからのペーシングを用いて心室再同期療法が行われました。CRTの適応となる患者さんの多くは重度の心不全(NYHAクラスⅢ以上)を有しており、そのまま心臓突然死のハイリスク群と捉えられ、極論を言えばポンプ機能を助ける心室再同期療法(CRT)の適応となる患者さん全例に、致死性不整脈による突然死を予防する植え込み型除細動器(ICD)の機能を併せ持つCRT-D療法がおこなわれてもいいかもしれません。(医療財源を考慮しなければ)
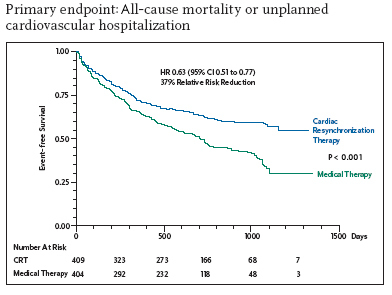
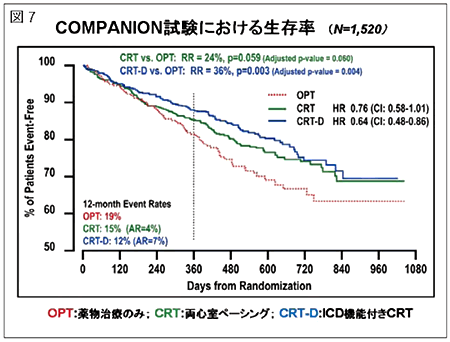
心室再同期療法の有用性を示したエビデンスとしては、MIRACLE試験、CARE-HF試験、COMPANION試験があります。MIRACLE試験では、心機能の改善、入院などのイベントの抑制などは証明されていますが、全死亡は有意差が認められませんでした。CARE-HF試験では、CRTが心不全患者の生命予後を改善させることを明らかにしました。COMPANION試験では、CRT療法よりCRT-D療法(ICD機能をプラス)の方が少しだけ生命予後をよくしました。日本のガイドラインでCRTの適応は、ACE阻害薬やβ遮断薬を含む心不全治療が十分に行われたNYHAクラスⅢまたは通院可能な程度のⅣの症候性心不全を有し、左室駆出率35%以下で、QRS幅130msec以上の症例です。しかし、実際は、CRTは約70%の症例にしか効果的でないことがわかっています。その原因としてはdyssynchronyの評価の問題、心筋障害の程度、心不全の重症度、突然死などが挙げられます。CRT-D療法は、心不全死と心臓突然死を抑制しより一層生命予後の改善に貢献することが期待されています。最近の大規模臨床試験はより軽症な心不全患者にもCRT-D療法が有効であることを証明しており、同治療法の適応拡大による最大の問題は不適切あるいは不必要なショックの送出で、今後はショックを可能な限り抑制するアルゴリズム設定の工夫が求められています。
人工心臓
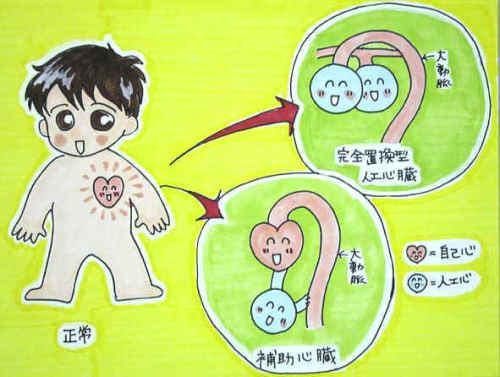
人工心臓とはそのポンプ機能を機械的に代行させるものです。人工心臓開発の発端は米国の心不全による死亡率の高さでした。1964年に連邦保健局に人工心臓プログラムが発足し、人工心臓は、半永久的に人工心臓に依存して血液循環を維持するもの(永久使用)として開発され、1980年代初めに臨床使用された完全置換型人工心臓はメディアに大きく取り上げられましたが、全例に脳血栓症をきたし数々の問題のためになかなか長期使用に耐えうるものできませんでした。一方、末期重症心不全のもう一つの治療法である心臓移植は、1967年には南アフリカで世界で初めて行われ、技術的にも進歩を遂げ治療法の一つとして確立されていきました。ところがドナー不足が深刻な問題となり、移植症例は頭打ちとなりました。そこで登場してきたのが心臓移植のドナー(心臓の提供者)が見つかるまでの一時的な使用を目的とするもの(ブリッジ使用)としての人工心臓の応用でした。1990年頃からはこのブリッジ使用としての左心補助心臓が主流となりました。
補助人工心臓 (VAD:Ventricular Assist device)は、様々な原因により急性あるいは慢性の経過から重度の心不全状態(急性心原性ショックを含む)に陥ってしまった心臓の代わりとして、血液循環を補助するポンプ機能を補う医療機器です。この装置は通常手術により直接心臓に取り付けられますが、術後に状態が回復すると装着している患者さんもある程度自由に動き回ることができます。補助人工心臓には血液ポンプが体外に位置する体外設置型のタイプと血液ポンプが体内に埋め込まれる植込型の2種類が存在します。それぞれの機種は患者様の状態や治療の目的によって使い分けられます。補助人工心臓を装着することで、薬物やペースメーカー治療といった従来行われる治療では治療困難な心不全の患者さんの血液循環を大幅に改善させることができます。時に補助人工心臓を装着することで弱った心臓を休ませることができ、その回復を図ることが可能です。回復が望めない場合には、心臓移植までのつなぎとして利用することもできます。
VADの適応
補助人工心臓は原則薬物やペースメーカー、通常の外科的手術といった従来行うべき治療によっても改善しない重症心不全の患者さんを対象として行われますが、植込型補助人工心臓を装着するには心臓移植適応を承認される必要があります(心臓移植の適応については心臓移植についての記載を参照ください。65歳未満の方が対象となります)。
植込型補助人工心臓の適応疾患
(2)拡張相肥大型心筋症
(3)虚血性心筋症(心筋梗塞などにより心臓が傷害され、心機能低下に陥った状態)
(4)心筋炎後心筋症
(5)一部の先天性心疾患
(1)上記植込型補助人工心臓適応疾患の急性増悪、心原性ショック例
(2)劇症型心筋炎による心原性ショック例
原則体外設置型補助人工心臓はすべての心原性ショック症例が適応となりえますが、高齢や全身状態不良(多臓器不全や敗血症など)により補助人工心臓の装着手術に耐えられない状態と判断される例や、補助人工心臓装着手術のリスクが得られるメリットを上回る場合には適応となりえません。また体外設置型補助人工心臓により救命できたとしても自己心機能が回復しなかった場合に、心臓移植の適応が承認された症例では植込型補助人工心臓への切り替えを行い、退院することが可能となりますが、心臓移植適応が承認されない症例では体外設置型補助人工心臓装着下での入院治療を継続することになります。そのため65歳以上の症例ではすでに年齢により心臓移植適応が承認されえないため、体外設置型補助人工心臓の適応は慎重に行われることになります。
心移植
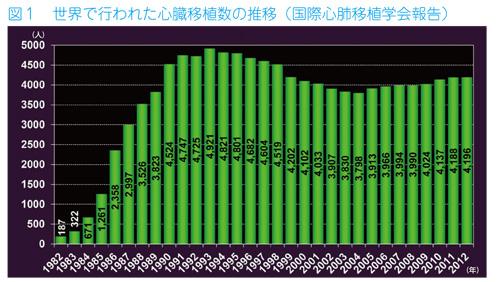
1967年、世界で初めて南アフリカで心臓移植が行われて以来、多くの国で広まってきました。欧米では1980年以降、従来の治療法では対応できない重症心不全の治療として心臓移植が受け入れられるようになり心臓移植の成績も向上し、心臓移植の実施数は1980年代半ば頃まで毎年倍増、その後も増え続け、1993年には年間4900例を超えるようになりました。その頃、バイク運転時のヘルメット着用や最高速度を減じるなど交通事故対策などの徹底もあって、脳死下での臓器の提供が減り、現在では世界中では4100例を超える実施数となっています。
移植に用いられる心臓は、すべて脳死者から善意で提供されたものです。心臓移植は、自分の心臓の代りに、ドナー(臓器提供者)から提供された病気のない心臓を植え込み、その働きによって延命だけでなく、社会復帰をも目指す治療法です。我が国では、臓器移植法が1997年10月に施行され、脳死と判定された人からの臓器提供が法的に認められ、2年後の1999年に臓器移植法に基づく心臓移植が行われました。しかし、臓器の提供には、本人が書面で提供の意思を示していることが必須とされていました。また、意思表示は民法上の遺言可能年齢に準じ15歳以上が有効とされていたので、15歳未満の人からは提供ができず、小児の心臓移植はわが国では実施できませんでした。
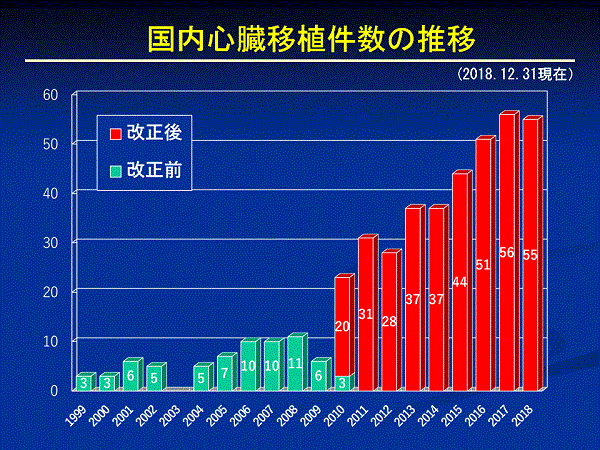
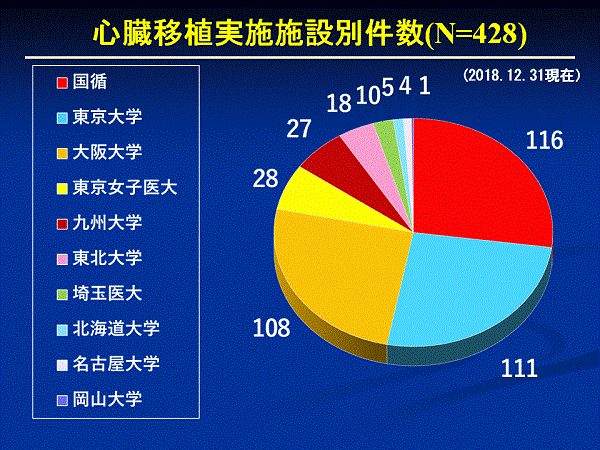
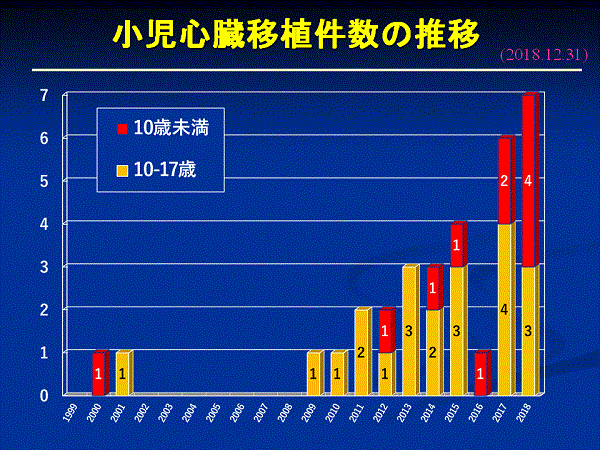
心臓移植の効果が知られるようになり、移植を希望する人も増えました。そのため移植までの待機期間は長くなり、わが国で心臓移植が受けられない年少の小児だけでなく、国内で心臓移植が受けられる体格の大きい小児や成人もアメリカやドイツなどで心臓移植を受けていました。しかし、海外に渡航して受ける移植は、世界のどの国も臓器提供者が足りないため、その是非をめぐって問題化し、2008年5月に国際移植学会は「移植が必要な患者の命は自国で救える努力をすること」というイスタンブール宣言を出しました。こうした動きのなかで、海外渡航移植に頼っていたわが国も、臓器移植法の改正に積極的に取り組むようになりました。2009年に改正臓器移植法が成立、2010年7月に施行されました。臓器移植法の改正によって、脳死者からの臓器提供は年間約10例から45例前後に増え、心臓移植も年間35例ぐらい行われるようになりました。この結果、改正前の12年間に行われた心臓移植は69例でしたが、改正後は2013年12月までの4年間で116例と着実に増えています。また、法改正に伴い身体の小さな小児(10歳未満:10歳以上はこれまでも成人のドナーからの心臓の提供が可能)の心臓移植が国内でも実施できるようになりました。心臓移植は、体の大きさに合った心臓が必要です。臓器移植法の改正で、本人の意思が不明な場合、家族の承諾によって臓器の提供ができるようになり、脳死と判定された15歳未満の子どもからも臓器提供ができるようになりました。また、臓器移植法の改正後、移植を受ける患者さん(レシピエント)を選ぶ基準として、18歳未満の人からの臓器提供があった場合、心臓移植では18歳未満で登録した希望者が優先されることになりました。改正臓器移植法施行後、脳死臓器提供が増加したことに伴い、心臓移植の実施数も増加し、2017年は56件でした。現在、国内で心臓移植実施施設(11歳以上の患者)として認定されている施設は、国立循環器病研究センター、大阪大学、東京大学、東北大学、九州大学、東京女子医科大学、埼玉医科大学、北海道大学、岡山大学、名古屋大学、千葉大学の11施設です。
2012年6月15日に、国内初の6歳未満小児の心臓移植が行われ、2014年11月24日に国内初の小児用補助人工心臓EXCOR(いわゆるBerlin Heart)を装着した6歳未満小児の心臓移植が行われました。2015年8月にEXCORが保険償還され、2018年8月末までに、EXCORを装着した20名の小児が心臓移植を受けています(海外13人、国内7人)
国内において、成人ドナー10人、小児ドナー22人から、32 人(女児14人、男児18人)の小児(18歳未満)が心臓移植を受けています。原疾患は、拡張型心筋症(DCM)25人、拘束型心筋症(RCM)1人、拡張相肥大型心筋症1人、心筋炎後心筋症2人、DCM/RCM 2人で、男児18人でした。
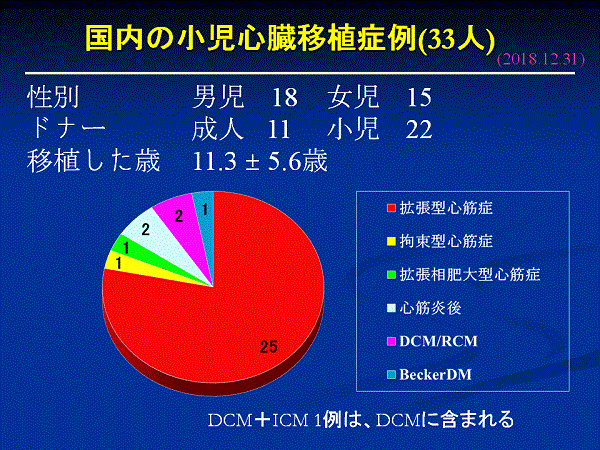
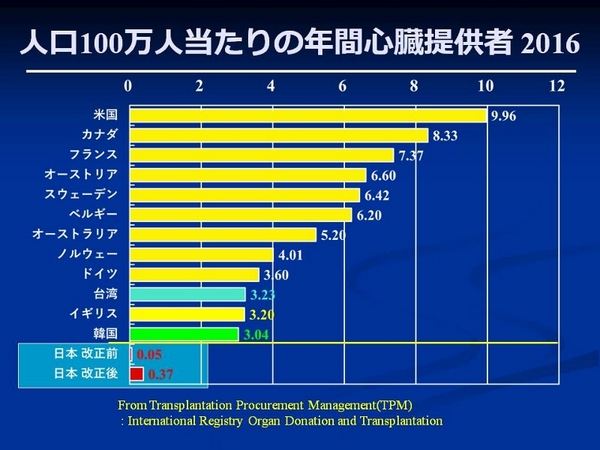
2009 年の人口100 万人あたりの心臓移植実施数を比較すると、アメリカやヨーロッパ各国が5-6 人であるのに対し、日本は0.05 人でした。台湾(3.7人)、韓国(1.3人)と比較しても、いかに少ない件数であったか分かると思います。法改正後、国内の心臓移植実施率も増加しましたが、2016年は51件でしたので、下の図にしめすように0.37人にしか至っていません。一方、この間、米国の9.96人をはじめ、各国の心臓提供率は増加し、韓国も3.04人にまで増加しています(韓国で人工心臓を必要とした人は1人です)。
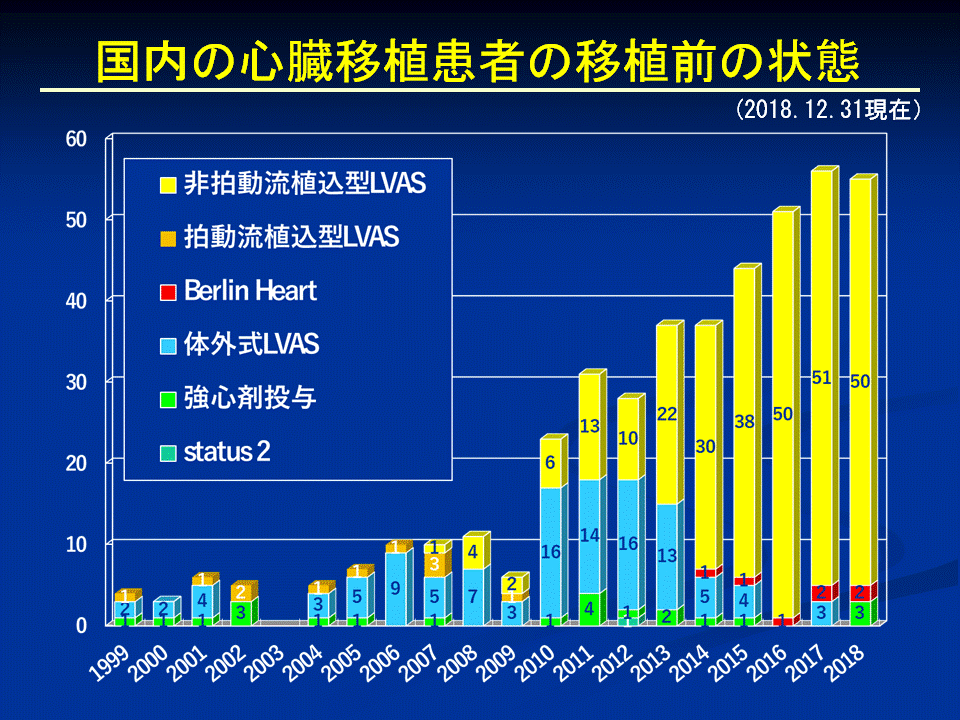
一方、国内での心臓移植件数が増加し、2013年2月には、ついに国内で心臓移植を受けた人数が、海外で受けた人数を追い越しました。2018年8月末までに国内で心臓移植を受けた408人は全て、移植直前の医学的状態の緊急度が非常に高いstatus 1の患者さんで、408例のうち386人(94.6%)に補助人工心臓(LVAS)が装着されていました。
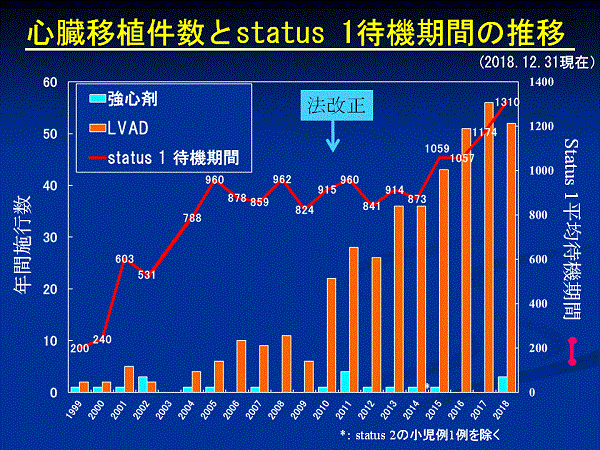
わが国の心臓移植適応患者の数は、日本胸部外科学会の委員会による検討では、年間228~670人と推計されています。これは心筋症と虚血性心筋疾患の患者を対象としたものです。心臓移植までの待機期間は心臓移植が開始された最初の2年間は7か月程度でしたが、その後移植希望者が増え、2005年からは2年半前後と海外に比べ著しく長くなっています。このため待機中に心不全が重症化し、補助人工心臓を装着して待機せざるを得ない状況になっています。国内で心臓移植を受けた人の待機期間は、平均1,077日(29~4,751日)で、status 1 での待機期間は平均942日(29~1,707日)、機械的補助期間(補助人工心臓の装着期間)は平均970 日(20 日~1,738日)でした。改正法が施行され心臓移植実施件数は増加し、status 1待機期間が短縮しましたが、その後、心臓移植を希望して登録する患者が急増したため、2015年以降は待機期間が逆に増加し、2018年は8月末時点で1,230日となりました。補助人工心臓を装着して待機する患者さんが急激に増えている反面、臓器提供は少ないため、移植への待機期間は依然3年前後という厳しい現実を示しています。
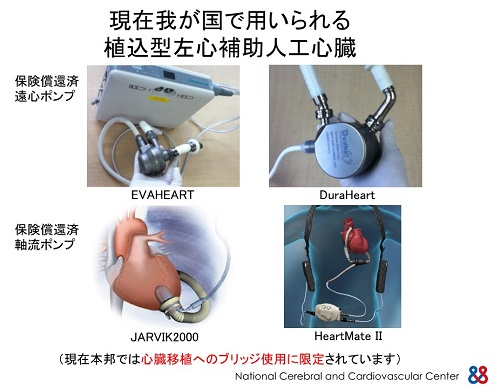
心臓移植への橋渡しとしての補助人工心臓は、心臓移植への橋渡しとして積極的に用いられるようになりました。2011年に日本で開発された2機種(EVAHEART、DuraHeart)と2013年、2014年には米国で開発されたHeartMateⅡ、およびJarvik 2000が、心臓移植へのブリッジとして健康保険で認められました。2011年春以降、心臓移植へのブリッジとして植込み型補助人工心臓が積極的に用いられるようになり、補助人工心臓をつけたまま自宅で待機する患者さんが飛躍的に増えています。補助人工心臓による在宅治療を行うには、患者さん本人、および家族を含めた介護人が、バッテリーや制御機器などの管理や、ドライブライン(体内に埋め込まれたポンプ部分と体外の電源・制御部分を結ぶライン)の皮膚を貫通する部分の消毒、血液を固まりにくくする治療などの管理ができることが必要です。また、患者さんは定期的に通院しなくてはなりませんし、緊急対応のために介護人が同居していることも必要です。移植希望者が飛躍的に増えました。現在300人を超える人が待機中です。心臓移植の適応年齢は、わが国では60歳未満が望ましいとされてきましたが、人口の高齢化と元気なお年寄りが増え、適応年齢の引き上げが課題となり、現在は65歳未満が望ましいとされています。心臓移植の適応年齢の引き上げによって心臓移植までのつなぎとして植込み型補助人工心臓を装着する人が増え、心臓移植への待機期間がさらに延びると考えられ、植込み型補助人工心臓を装着した患者さんは、その状態で長期にわたって生活する覚悟が必要です。
移植直後から血液の全身循環を維持するため、移植された心臓は正常か、それに近い状態で働かなくてはなりません。だからドナー心は心臓病のない人から提供されます。この手術は、移植を受ける患者を全身麻酔し、人工心肺によって血液循環と呼吸を維持しながら行います。ドナーの体から取り出した心臓の保存時間には限界があるため、心臓を取り出してから患者に植え込むまでの処理のすべてを、原則として4時間以内に終えなければなりません。このため、ドナーから取り出す手術と移植手術を時間的にうまく連携して行うことが成功の必須条件です。脳死者がいつ出るか予測することはできませんし、その数も限られていますから、移植が必要になった患者は、提供があるまで待機する必要があります。ドナー心が提供されるとき、当然のことですが、その心臓に最も適した人が移植手術に選ばれます。この選定は、移植希望者として「日本臓器移植ネットワーク」に登録された患者の中から、ドナーとの血液型や体重が適合しているかどうか、移植手術の緊急性、さらに登録後の待機期間の長さなどをもとに、公平に行われます。
無事、移植手術が終わっても注意すべき点が少なくありません。他人の心臓は自分の体にとって異物となりますから、移植すると程度の差はあっても、必ず自己の免疫反応によって、移植された心臓を排除しようとします。これが「拒絶反応」です。もし拒絶反応が起これば、移植した心臓の機能は低下し、重症の心不全になるおそれがあります。これを防ぐために、移植手術後は免疫抑制剤の服用を続けなければなりません。
拒絶反応を診断する方法として、現在は定期的に行う「心筋生検」が最も信頼度が高いとされています。この検査は、静脈を通じてカテーテルを右心室に入れ、心室の筋肉の一部を採取して、顕微鏡で心筋や細い血管に異常がないか調べるものです。心筋生検は、心臓移植手術後の3週間は1週間ごとに、その後は2週間、6週間、8週間後に検査し、経過が良好であれば、1年後まで3か月ごとに行います。1年を過ぎると拒絶反応の兆候がなくても6か月ごとに検査を続けます。拒絶反応の治療は、免疫抑制剤の量を増やすか、他の免疫抑制剤を加えることによって行います。ときには血しょう交換もします。いかなる治療をしても拒絶反応がおさまらず、心機能が低下して心不全になり、そのままでは生命の維持が困難と判断された場合は、再び移植が必要になります。
予防的免疫抑制療法として世界の多くの施設で行われている方法は、「シクロスポリン、アザチオプリン、ステロイドホルモン」の3剤併用です。これらが併用されるようになってから、拒絶反応が起きてもその程度が軽くなり、心臓移植の成績は向上してきました。この予防的療法をしても拒絶反応が生じた時には、普通、メチルプレドニンを短期間に大量使用しますが、十分な効果が得られない難治性の拒絶反応の場合はT細胞抗体が使われます。免疫抑制剤の副作用には、感染を起こしやすいこと、顔が満月のような容貌になること、高血圧、腎臓や肝臓の機能低下、骨がもろくなる骨粗しょう症などがあり、これらに対する治療が必要になる場合があります。移植直後や急性拒絶反応を認め強力な免疫抑制療法を行う時は、無菌室などを使ったり、マスクをかけたり、感染予防対策を実行することが必要で、厳重な生活制限を受けることになります。普通は移植手術後、徐々に生活制限を緩めていきます。心臓移植手術をしてから、状態が安定し、拒絶反応も軽度以下であれば、2~3か月で退院することができます。その後、徐々に外出などを進めていけば、半年程度で社会復帰が可能となります。しかし、移植手術を受け健康を取り戻した後も、一生、免疫抑制剤を服用しなければならず、常に感染と拒絶反応の危険と隣り合わせにいることになります。さらに、心筋生検を含む種々の定期的検査を受けなければならない煩わしさがあります。移植医療に伴うこうした特殊性を、患者と家族がよく理解し、日常生活の注意事項を守ることによって、社会復帰や復職・復学が可能になるのです。
移植された心臓と、移植を受けた患者の体の神経はつながっていません。神経がとり除かれた心臓という意味で「除神経心」といいます。患者の体の神経とはつながっていないので、心臓に対する神経系の調節は働きませんが、内分泌系(ホルモン)による支配は受けています。運動したとき、脈拍数は正常な人に比べ遅れて増加しますが、普通の運動能力は保つことができます。移植後、長期間経過してから心臓に栄養を与える冠状動脈が硬くなる「冠動脈硬化症」が起き、病状が進む場合があります。このとき、狭心症や心筋梗塞症の胸痛を感じることはできませんから、全身状態の定期的な検査が欠かせません。
心不全が悪化してくると、心移植しか治療法がなく、ドナーが見つかるまでは人工心臓を使って延命していたが、その期間は欧米では平均半年、日本では2.5~3年かかった。人工心臓の問題点はいくつかあり、そのもっとも大きな問題点は血栓ができることであり、心臓移植を行える状態になった人の1/3に脳梗塞が発症していた。近年人工心臓が改良され、拍動流から定常流にポンプの方式が変更されたことに伴い小型化でき、血栓形成の危険度も減少してきた。その結果人工心臓を入れている状態の予後が改善し、5年生存率が80%にまでなってきて、心臓移植の治療効果とそん色がない状況にまでなってきた。その結果、心臓移植を行う必要性が無くなり、人工心臓挿入自体が最終治療法の一つとなってきた。(現時点での人工心臓の問題点は、少なくなったとはいえ、血栓形成の危険があり、抗凝固剤の服用が必要であり、感染の危険性もゼロではないといった問題点がある。)その結果移植の適応として欧米では65歳未満となっている。
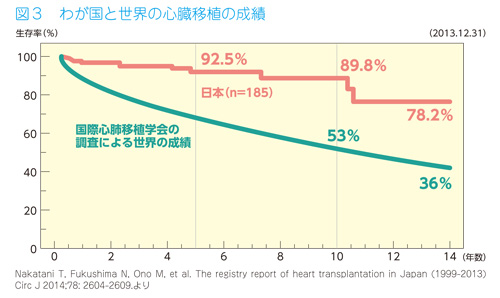
国際心肺移植学会の報告では、心臓移植の成績は1年生存率が81%、10年生存率53%で、27年以上生存している人が108人と報告されています。また、最近の生存者を3年目まで追跡した調査では、90%前後の方が普通の日常生活を送っています。心臓移植後の患者さんが亡くなる原因には、拒絶反応、感染症に加え、移植された心臓の冠動脈の狭窄や閉塞、悪性腫瘍などがあります。わが国での心臓移植の成績は、2013年12月までの185例では、12例が亡くなっていますが、5年生存率は92.5%、10年生存率が89.8%と、国際心肺移植学会の調査報告による世界の平均10年生存率53%をはるかに上回っています。
心臓移植の適応とならない重症心不全の患者さんに対する内科的治療と植込み型補助人工心臓治療の効果を比較した研究で、補助人工心臓治療の効果が高いことが確かめられ、欧米では、心臓移植の適応とならない重症心不全患者に対する治療として植込み型補助人工心臓が最終的治療(いわゆるDestinationTherapy)として受け入れられ、積極的に進められています。非拍動流型が用いられるようになると、システムの耐久性が向上し生存率がよくなり、現在では広く行われるようになっています。わが国でも心臓移植の適応とならない重症心不全患者に対し治療の選択肢の一つとするため検討が始まっています。
心臓リハビリテーション
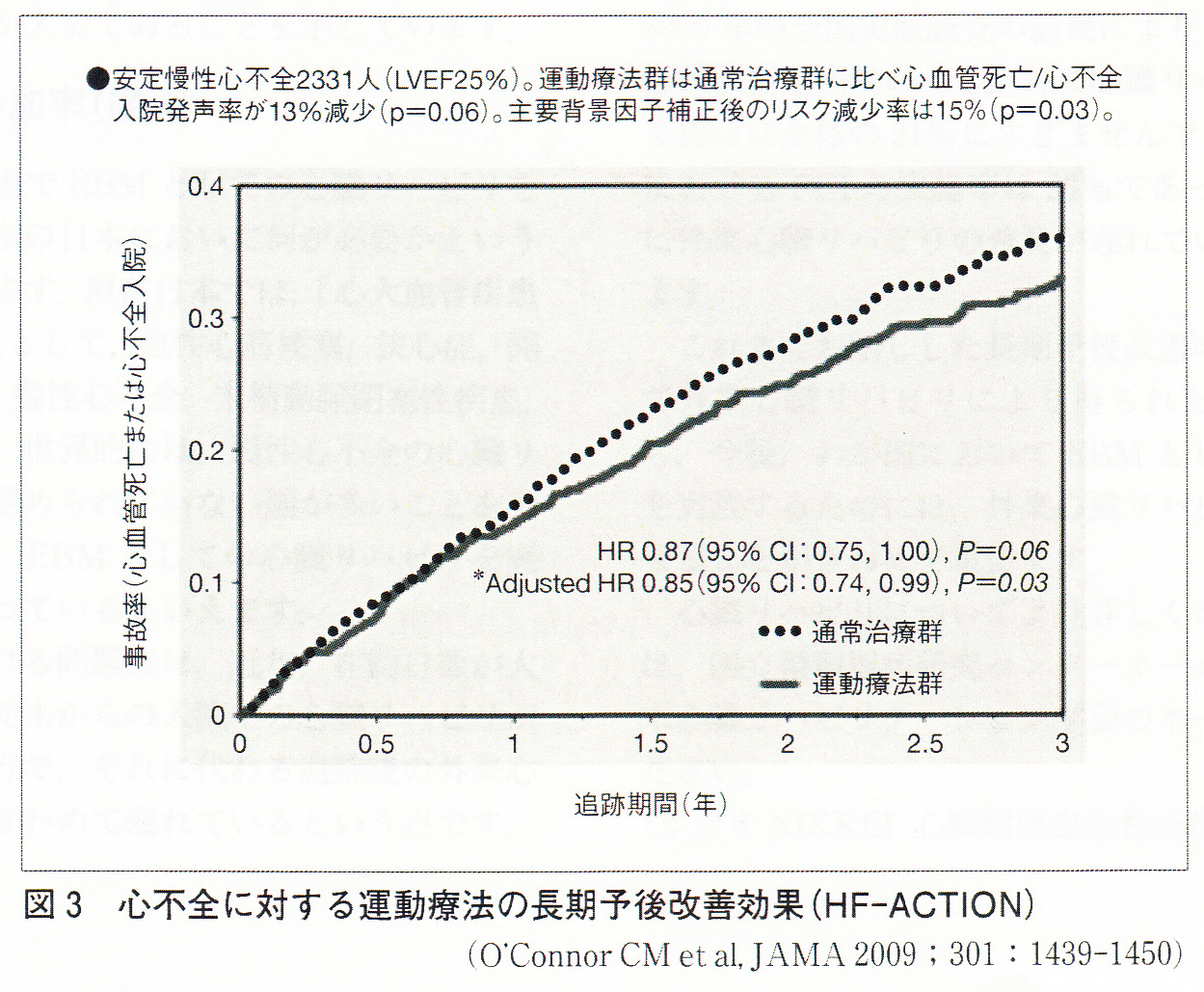
2007年、約2,300人の慢性心不全患者を対象として実施された大規模臨床試験HF-ACTION において運動療法群では通常治療群に比べて,あらゆる死亡または入院が主要背景因子の補正後に有意に13%低下することが示されました。
米国、カナダ、フランスの82の多施設から合計2331人の患者が登録されました。 各無作為化群における患者のベースライン特性を示す。 全患者の年齢の中央値は59歳でした。 28%が女性であり、40%が人種的または少数民族であった。 左室駆出率の中央値は25%であり、患者の51%が虚血性の病因を伴う心不全を有していた。 アンジオテンシン変換酵素(ACE)阻害薬またはβ遮断薬に対する不耐性または禁忌のない患者のうち、95%がβ遮断薬およびACE阻害薬またはアンジオテンシン受容体遮断薬(ARB)のいずれかを服用していた。 患者の45%が、登録時に植え込み型植込み型除細動器(ICD)または両心室ペースメーカーを植えていました。
| 特徴 | 患者数(%) | |
|---|---|---|
| 通常のケア (n = 1172) |
運動トレーニング (n = 1159) |
|
| 年齢、中央値(IQR)、y | 59.3(51.1〜68.2) | 59.2(51.2〜67.8) |
| 女性のセックス | 314(26.8) | 347(29.9) |
| ヒスパニックまたはラテン系の民族 | 48人(4.1人) | 40(3.5) |
| レース | ||
| 黒人またはアフリカ系アメリカ人 | 372(31.7) | 377(32.5) |
| 白 | 728(62.1) | 698(60.2) |
| その他の | 56(4.8) | 65(5.6) |
| NYHAクラス | ||
| II | 754(64.3) | 723(62.4) |
| III | 409(34.9) | 422(36.4) |
| IV | 9(0.8) | 14人(1.2人) |
| 心不全の虚血性病因 | 599(51.1) | 598(51.6) |
| 左室駆出率、中央値(IQR)、% | 24.9(20.0 – 30.2) | 24.6(20.0 – 30.0) |
| 糖尿病 | 370(31.6) | 378(32.6) |
| 以前の心筋梗塞 | 499(42.6) | 480(41.4) |
| 高血圧 | 676(57.7) | 712(61.4) |
| 心房細動または心房粗動 | 241(20.6) | 247(21.3) |
| Beck Depression Inventory IIスコア、中央値(IQR) | 8(4〜15) | 8(5〜15) |
| 収縮期血圧、中央値(IQR)、mm Hg | 111(100〜126) | 112(100 – 126) |
| 拡張期血圧、中央値(IQR)、mm Hg | 70(60〜80) | 70(61-78) |
| ナトリウム、中央値(IQR)、mEq / L b | 139(137-141) | 139(137-141) |
| 血中尿素態窒素、中央値(IQR)、mg / dL b | 21(15〜28) | 20(15〜28) |
| 血清クレアチニン、中央値(IQR)、mg / dL b | 1.2(1.0〜1.5) | 1.2(1.0〜1.5) |
| 医薬品や機器のベースライン使用 | ||
| ACE阻害剤またはARB | 1094(93.3) | 1105(95.3) |
| β遮断薬 | 1112(94.9) | 1091(94.1) |
| アルドステロン受容体拮抗薬 | 528(45.1) | 523(45.1) |
| ループ利尿薬 | 921(78.6) | 895(77.2) |
| ジゴキシン | 547(46.7) | 499(43.1) |
| 植え込み型除細動器 | 448(38.2) | 490(42.3) |
| 両心室ペースメーカー | 203(17.3) | 216(18.6) |
| 機能対策 | ||
| 徒歩6分、中央値(IQR)、メートル | 373.2(300.0〜 432.5) |
365.8(296.3〜436.2) |
| 心肺運動時間、中央値(IQR)、分 | 9.7(7.0〜12.1) | 9.5(6.9〜12.0) |
| ピーク酸素消費量、中央値(IQR)、mL / kg /分 | 14.5(11.6〜17.8) | 14.4(11.3 – 17.6)
|
心臓リハビリによる長期予後改善効果は,運動や食事療法による冠危険因子の改善から予測される程度よりはるかに大きいことからむしろ運動療法による「血管内皮機能改善効果」,「抗炎症・抗酸化ストレス効果」,「自律神経機能改善効果」などの生物学的効果によるところが大きいと考えられていることです。
在宅運動の目標トレーニングレジメンは、心拍数予備率の60%〜70%の心拍数で40分間、週5回でした。個人差はありますが、従来行っている運動療法よりはちょっときつめですね。いつもは、ちょっと早足で30分以上、週3回以上って言っているのもそうそう間違いではなさそうです。やらないよりやった方がいいですよね。
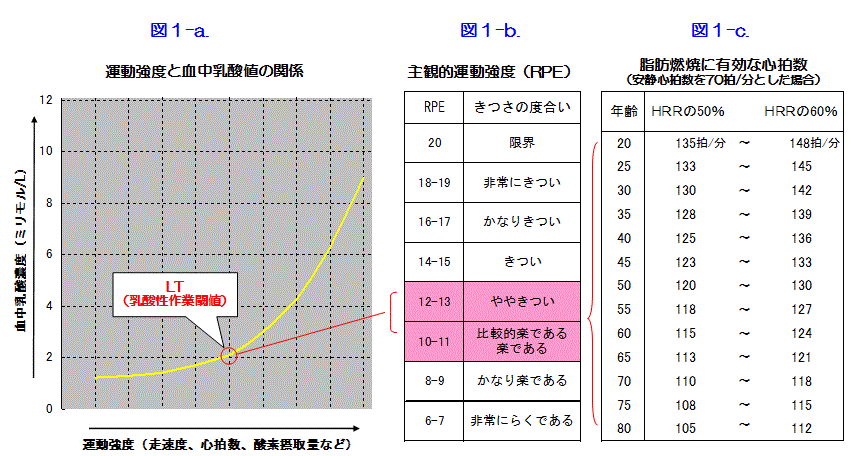
実際にLTを知るためには、上述したように運動中の血中乳酸濃度を測る必要がありますが、それには専門的な測定機器と熟練した測定者が必要となるのが難点です。そこで、一般的には、年齢から推定される最高心拍数(=予測最高心拍数:「220ー年齢」で計算します)と安静時心拍数の差(心拍予備量=HRR:Heart Rate Reserve)を求め、その50~60%を安静時心拍数に加算したものを目標心拍数(THR:Target Heart Rate)として設定する方法が広く用いられています。たとえば、年齢60歳で、安静時心拍数が70拍/分の人の場合の目標心拍数は、
<年齢が60歳で、安静時心拍数が70拍/分の人の場合>
目標心拍数={(220-年齢)–安静時心拍数}×0.5~0.6+安静時心拍数
={(220-60)-70}×05~0.6+70=115~124拍/分
になります。
この式で求めた心拍数は、主観的には「比較的楽である」~「ややきつい」と感じられ運動強度(図1-b:主観的作業強度〔RPE〕を参照)であり、概ねこれがLTレベルに相当するとされています。この式によって計算した各年代別の目標心拍数を図1-cに示しましたので参考にしていただけたらと思います。
運動強度は、3〜4メッツぐらいでいいんではないでしょうか?
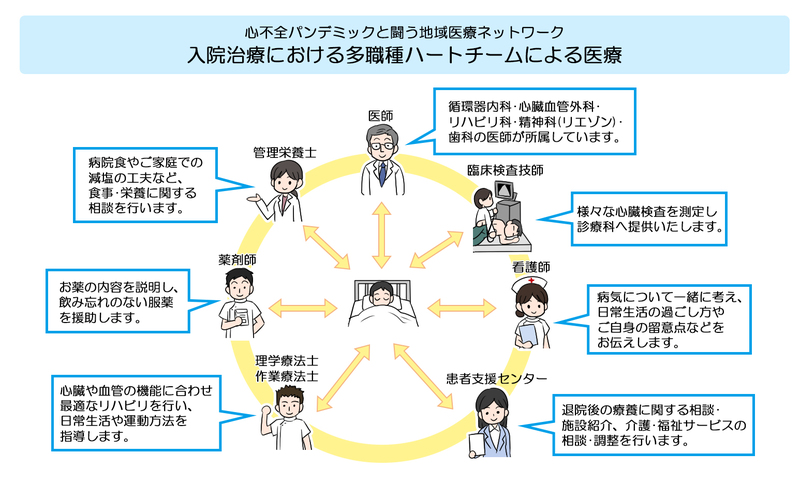
地域の多職種連携
最期に心不全のパンデミックにどう対応していけばいいんでしょうか。人口の高齢化に伴いますますの増加が予想される慢性心不全の増悪予防には患者の特性を把握しながら適切な診療方針を選択し、包括的に治療を行っていくことが大切となります。いづれにしろ、心不全の終末期には、急性増悪による入退院を繰り返す時期がやってきます。心不全には今回はダメという本当の終末期(がんと違ってこれがいつなのかがわかりにくい)を迎える前に末期の状態が長期間存在するという他の疾患と大きく異なる特徴があります。末期とは具体的には最大限の薬物治療でも治療困難な状態で場合によっては人工呼吸や補助循環を導入して回復する状況です。もう治療法がない終末期と比べ医師は「まだ助けられるかも」と治療方針を最も迷う時期です。つまり、断続的に増悪するという心不全の性質により,どこから末期なのかがわかりにくいことも,治療方針の選択を難しくしています。この対応は、その地域の医療資源によって変わってくるのではないかと思います。確かに姫路循環器病センターや姫路日赤などの専門性の高い病院では、心不全の患者さんであふれ、入院は難しいかも知れませんが、たつの市内の一般病院のベットは十分に活用可能な状態で維持されるのではないかと思っています。「まだ助けられるかも」と迷っている間は、自分自身の中に医療の差し控えを懸念しており、入院治療が基本だと思います。
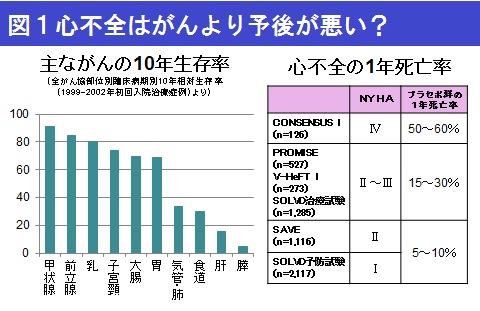
米国のガイドラインでは「心機能が悪い場合,1年以内に約半数が亡くなるという報告がある」と伝えた上で,治療を選択すべきとされています。国立がん研究センターなどの研究班が発表したがん患者の10年生存率(全がん協ホームページ)によれば、がんの発生部位によって予後に大きな差がありますが、がん全体の10年生存率は約58%でした。一方、心不全では、一番重篤な患者さん(NYHA分類 Ⅳ度)では、1年で50~60%が亡くなります。ですから、重篤な心不全の予後は、がんと同程度といえます。
欧米のガイドラインでは,状態が悪くなり始めたときを末期ととらえ,医師一人で抱え込まないよう心不全患者を地域で診るという視点で多職種で長期にわたる患者支援を行うのが重要とされいます。多職種が介入する心不全の疾病管理プログラムは、構成メンバーが患者・家族、医師、看護師、薬剤師、栄養士、リハビリスタッフ、ケアマネ、ソーシャルワーカーなどです。やすらかな最期を迎えたいと願う心不全患者は多いものの、急変時には望まない処置がしばしば行われるため事前に方針を決めることが末期医療の前提です。急変時には治療方針を考える時間がないため,事前に話し合う必要があります。
心不全は自分で管理する
そして、最も重要なのが患者自身による自己管理です。いくら病状が良くなって退院しても、水分、 塩分、食事、服薬などの管理ができないと、すぐに心不全が悪化し再入院になってしまいます。そのため、多職種(医師、看護師、介護士、薬剤師、理学療法士など)による心不全に関する患者教育を行い、在宅での自己管理ができるよう指導を行います。
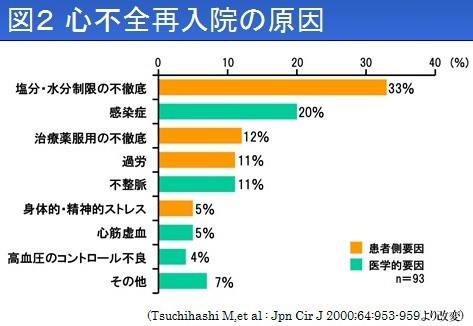
慢性心不全の治療では患者さんによる食生活の管理が重要になります。まず塩分を控えることが重要です。軽症の患者さんで1日食塩7グラム以下(高血圧学会は6グラム以下を提唱しています)、重症の患者さんで3グラム以下を目安に制限します。カップラーメンには食塩が5~7グラム含まれています。買うときに食塩の含まれる量をよく見て、汁まで飲まないようにしましょう。次に、水分を取りすぎないことです。むくみ、体重増加が大きい場合には、医師から制限されることがあります。そして、必ず禁煙、原則として禁酒です。日常生活では十分な休養と適度な運動を心がけ、精神的・身体的ストレスを生じないように無理のない生活を送ることが大切です。また、薬は正しく服用しましょう。服薬時間と回数を守り、自己判断で中止や変更をしてはいけません。急性増悪による再入院の 原因は、塩分・水分制限の不徹底、治療薬服用の不徹底、過労やストレスといった患者さんの要因が6割を占めています。ですから、日常生活の注意をよく守り、毎日、体重や排尿、むくみなどのチェックを心がけ、悪化の兆しがみられたら、かかりつけ医に報告してください。
また、心不全では,例えば動悸が存在しても,患者さんは「胸の辺りがワサワサして気持ち悪い」といった自覚しかなく,医療者と患者さんの認識が異なることが多いため,心不全の症状をまず患者さんに理解してもらいます。また体重を測定していても,患者さん自身が「体重が急に増加したら受診が必要」と認識していなければ意味がないため,心不全看護師はセルフモニタリングの具体的な指導を患者さんに行う予定です。
低栄養も問題となります。心疾患や高血圧症の高齢の慢性患者では高率に栄養障害が発生することが報告されています。栄養状態が悪いほど感染症の発症率が高くなり在院日数の長期化にもつながります。低栄養は心不全の明確な予後悪化因子となっています。エネルギーとタンパク質の補給、水分の管理の三つが重要だと思います。
ハートノート
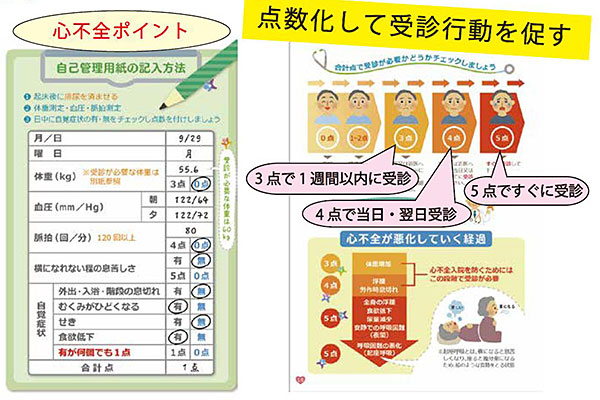
そして、最も重要なのが患者自身による自己管理です。いくら病状が良くなって退院しても、水分、 塩分、食事、服薬などの管理ができないと、すぐに心不全が悪化し再入院になってしまいます。「ハートノート」は、大阪市内の大阪市立総合医療センター・北野病院・旭区医師会を中心に開発された心不全管理用のノートです。記載項目としては、体重、脈拍、自覚症状があります。
体重は、退院したときの体重を基準体重として、患者個別にこれ以上増加しては危険・受診が必要という体重を設定します。大体3kgくらい増えると危険・受診が必要、と設定しますが、体重の少ない人は1kg増えたら危険と設定される場合があります。受診が必要な体重を超えたら3点つけます。脈拍は120/分を超えたら4点が加算されます。症状として、横になれない程の息苦しさがあれば、5点です。
その他の自覚症状として、①外出・入浴・階段昇降時の息切れ②むくみがひどくなる③咳④食欲低下の4項目いずれかがあれば1点加算です。ただしこの4項目はいくつあっても1点です。このように点数(心不全ポイント)をつけ、その合計点により、 自分の病状を評価します。3点で一週間以内に受診。4点で当日・翌日受診、5点以上で救急受診を指示しています。5点以上になっての受診では入院もやむなしかもしれませんが、3点4点の間に受診ができて薬の調整ができると入院は回避できるのではと考えられます。
在宅で心不全患者を診療していくツー ルとなります。このシステムが地域に浸透すれば、地域医療に関わる者が同じ基準で心不全増悪を早期に発見し、入院を予防することができ、患者が安心して生活できる場を提供できると考えています。